|
Enfermedades quisticas renales 3.
Indicadores de transducción: muchas vías con indicadores de transducción han sido implicadas en los procesos etiológicos de PQR. Los productos genéticos PKD1, PKD2 y NPH1 pueden asimismo activar cascadas que regulan la proliferación, la migración y la diferenciación.
La integración de estas vías es esencial para los movimientos celulares de morfogénesis subrayados y la formación y mantenimiento de los túbulos renales con diámetro luminal correcto.
La policistina inicia estas vías a través de interacciones de varias proteínas con complejos de adhesión unidos célula-célula y célula-matriz focal.
La pérdida de la función adhesiva focal en la policistina mutada, resulta del fallo para recuperar la kinasa de adhesión focal en pacientes con PQRAD y en la mutación de la nefrocistina en la nefronoptisis, que causan la formación de quistes. La regulación adicional de la función de la policistina ocurre por influencia de G proteínas, la fosforilación por kinasas séricas o la tirosina kinasa, la defosforilación por la proteína receptora tirosina fosfatasa y el segundo mensajero intracelular de calcio y AMPc.
Los complejos de Policistina 1 son encontrados en la interfase célula-matriz, en los contactos célula-célula y en la luz ciliar, donde son pensados para que funcionen como sensores del medio extracelular e interactúen con las proteínas de la membrana celular, la actina y el citoesqueleto tubular y con los indicadores de transducción para entender las cascadas de fosforilación intracelular de la regulación de los genes de transcripción en los núcleos. La Policistina 1 interactúa con la Policistina 2, la alfa 2 beta 2 integrina, el receptor de la proteína tirosina fosfatasa (RPTP) y la cadherina E para las membranas celulares, en adhesiones focales para las uniones adherentes y en la cilia central del túbulo colector. En la fase intracelular, la Policistina 1 interactúa con las proteínas de adhesión focal talina (TAL), la paxillina (PAX), la vinculina (VINC), la kinasa de adhesión focal (FAC), la c-src (SRC), la p130-cas (CAS), la nefrocistina (NPH1), la kinasa rica en prolina pyk-2 (Py), la tensina (TEN) y con las proteínas de unión adherentes alfa 2 y beta 2 y la alfa cedenina y la cadherina E, que podrían regular la adhesión focal célula-matriz y la adhesión célula-célula respectivamente.
La Policistina 2 y el receptor pasajero potencial de los canales de calcio (TRPC-1) pueden facilitar la entrada de calcio, que podría actuar como un segundo mensajero intracelular. El segundo mensajero AMPc, tanto como las proteínas G, podrían regular la función de las policistinas a través de las interacciones con los sitios definidos de Policistina 1 C-terminal.
La Policistina 1 C-terminal contiene sitios para fosforilación en serie, como las proteínas A y X y las tirosinas como c-src y la kinasa de adhesión focal, tanto como la prolina enriquecida src homóloga 3 (SH) y los sitios supuestos WW. Las cascadas de los indicadores de transducción inducidas por el complejo de policistina, incluyen aquellos de las vías W [beta catenina y células T (TCF)], los factores de transcripción de mejoramiento linfoideo, las vías de adhesión ocal (la MAP kinasa y JUN kinasa), los activadores de transcripción proteica 1 (AP-1) y la vía de regulación transcripcional de proliferación, apoptosis, diferenciación epitelial, polaridad, adhesión, migración, formas celulares y diámetro tubular, que son todos componentes de la morfología renal.
En el epitelio normal, la Policistina 1 (Fig. 12) interactúa en un complejo de multiproteínas, con proteínas integras y de adhesión focal, incluyendo la kinasa de adhesión focal (FAK). En el epitelio de pacientes con PQRAD, aunque la policistina 1 y los complejos de adhesión focal están formados, ellos carecen de FAK, TAL, Talina, paxicilina, vinculina, CAS p130-cas, SRC c-src, tensina y nefrocistina.
Actualmente las evidencias sugieren que la línea de complejos de señalamiento de policistinas, segundos mensajeros intracelulares y factores de crecimiento coordinan la proliferación, diferenciación y morfogénesis de las células tubulares renales, a través de interacciones con complejos de proteínas conectados a la actina del citoesqueleto, a cascadas de indicadores intracelulares y a la regulación de los genes de transcripción. Las alteraciones de estos mecanismos reguladores por mutaciones en PKD1, PKD2 o NPH1 descomponen estos procesos.
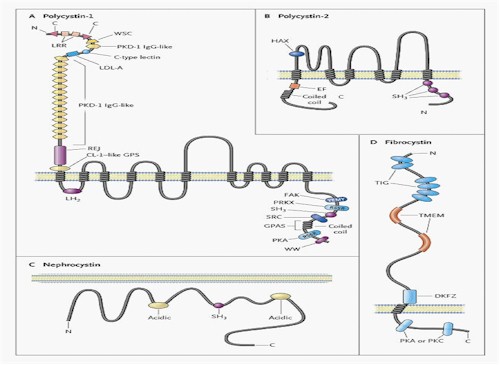
Fig. 12. Estructura de las proteínas del quiste.
Cilias: las principales células de los túbulos renales tienen una cilia solitaria central, cuya función es obscura. Intrigantemente, los ratones afectados con PQRAD tienen una estructura y función ciliar anormal y ello afecta a las proteínas que coexisten con la policistina de las cilias en los túbulos colectores. Sin embargo, se desconocen donde estas anormalidades se aplican en PQRAD en humanos, que involucran al gen PKDH1 mutado. Estudios genéticos en un gusano (Caenorhabditis elegans) y estudios funcionales en punciones celulares y en un ratón con PKD1 mutado, sugieren un rol sensible de la cilia en PQRAD.
Biología Molecular: Un amplio rango de mutaciones en PKD1 o PKD2 puede causar enfermedad renal poliquística. Estas mutaciones se extienden atravesando la secuencia entera de estos genes e incluyen supresiones, inclusiones, cambios de estructura y uniones absurdas, sin sentido, en lugares de mutación. En parientes, las mayores mutaciones incluyen una proteína truncada y son únicamente para a una sola familia.
PKD1 es el más largo con 46 exones e incluye un transcriptor de 14,5 kb. La existencia de PKD1 adicional como genes homólogos de la región 5 de PKD 1, complica considerablemente el análisis de la mutación. Más de 100 mutaciones han sido identificadas.
En contraste, PKD2, un gen con 15 exones simples, incluye un transcriptor más pequeño de 5,6 kb. Más de 75 mutaciones han sido identificadas, en contra principalmente del tipo inactivado.
Los pacientes con PQRAD son heterocigotos, teniendo heredado un alelo mutante y uno normal (tipo grande) de PKD1. Un mecanismo “dos golpes” ha sido propuesto para explicar como crecen los quistes. Este mecanismo no solo requiere una mutación de la línea germinal de PKD1 y 2, sino una mutación somática adicional en el gen tipo grande para iniciar la formación de los quistes. Aunque tales segundos golpes (lugares de mutación) ocurren con los quistes individuales solamente, las frecuencias son bajas (17 % en PKD1 y encima del 43 % en PKD2) y la policistina es vista en muchas de las células del epitelio del quiste de riñones de pacientes con PQRAD. La evidencia sugiere que la mayoría de los lugares de mutación somática, permiten la transcripción del alelo tipo grande mutado o del bloque de la producción de policistina 1 y 2.
Aunque la pérdida completa de PKD1 o PKD2 claramente causan formación masiva de quistes renales; este es un efecto de dosis genética, donde cualquier PKD pequeño (con ausencia completa de haploinsuficiencia) o PKD1 grande (con sobrecompresión transgénica), también causan formación de quistes. 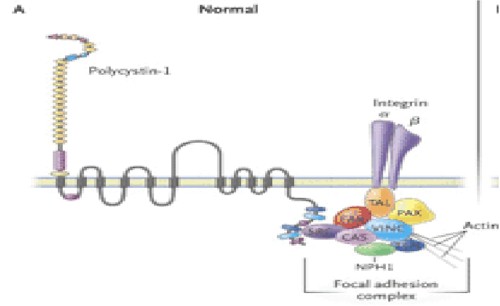
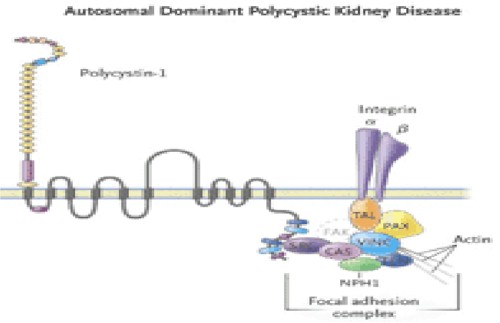
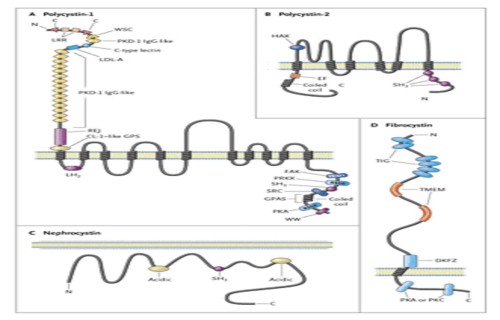
Fig. 13: Estructura de las proteínas de la Poliquistosis renal (PQR).
El gen de PQRAR, PKHD1, tiene 67 exones e incluye un transcriptor grande de 16,2 KB. Existen múltiples variables unidas y varias mutaciones diferentes han sido detectadas a lo largo de la región entera codificada. La mayoría de las mutaciones predicen la traslación de una proteína truncada.
Proteínas de la Enfermedad Poliquística Renal:
Policistina 1: es una proteína grande de la membrana (mayor de 460 kD) con un N-terminal extracelular largo, 11 áreas transmembrana y un C-terminal intracelular corto (Fig.13). Esta porción contiene motivos estructurales para comprometer a las proteínas de la matriz y a las células de la membrana en el medio del epitelio tubular renal. La porción intracelular de la proteína tiene muchos sitios de fosforilación y responde a los reguladores de los señaladores de transducción. La Policistina 1 interactúa y forma complejos con muchas otras proteínas en el plano de las células de la membrana y en la fase intracelular de la membrana que conecta el medio extracelular al citoesqueleto de actina intracelular.
Policistina 2: la proteína policistina 2 PKD2-codificada es una proteína de la membrana de 110-kD, con seis zonas transmembrana y áreas transmembrana con un N- y un C-terminal intracelular, con estructuras similares a los canales de sodio y calcio activadores de voltaje tipo L (Fig.13). El análisis estructural del sitio de la policistina 2 en el familiar potencial receptor pasajero de los canales de proteínas, muestra juntos también a la reciente identificada policistina para canales de calcio PKDL y PKD2L2.
Aunque la policistina 2 puede funcionar como un canal de catión no selectivo que es permeable al calcio, esto es incierto, porque sola y únicamente puede formar un complejo con policistina 1 para la membrana celular o en el retículo endoplásmico.
Fibrocistina: aunque poco se conoce sobre la proteína larga (447-kD) involucrada en PQRAD, la fibrocistina (solo conocida como poliductina), la estructura sugiere que es un receptor integral con sitios de interacción proteica intracelular y sitios de fosforilación intracelular. Las mutaciones causantes de la enfermedad de PKHD1 con C-terminal truncado de fibrocistina, remueven o inactivan a los sitios de señalamiento putativos. La fibrocistina es abundante en los túbulos colectores de riñones fetales, pero está ausente en los riñones de varios pacientes con PQRAR. Tomándolas juntas, estas propiedades sugieren que como la policistina 1, la fibrocistina podría actuar como un receptor de membrana, interactuando con proteínas extracelulares ligadas y con señaladores de transducción intracelular en el núcleo.
Nefrocistina: diferente a la policistina y fibrocistina, la nefrocistina es una completa proteína intracelular pequeña (83-kD). La policistina y nefrocistina probablemente interactúan con las proteínas del complejo de adhesión focal, en quienes la fosforilación activa las vías de señalamiento intracelular. Las evidencias apoyan la existencia de un rol central para el complejo de adhesión policistina- nefrocistina en puntos de adhesión focal en la matriz celular para la regulación de la geometría tubular.
Funciones de las Policistinas: un amplio rango de análisis ha concluido que las funciones de la policistina 1 como receptor de la membrana capaz de ligarse e interactuar con muchas proteínas, carbohidratos y lípidos, provoca una respuesta intracelular a través de las vías de fosforilación y que la policistina 2 actúa como un canal permeable de calcio. La policistina 1 es encontrada entre los tres sitios principales de las células renales tubulares: el complejo de adhesión focal matriz-célula, las uniones célula-célula, y la cilia; cada uno de ellos relaciona el medio extracelular de la membrana celular al citoesqueleto intracelular actina-tubulina.
Como las múltiples interacciones con otras proteínas y las modificaciones por fosforilación, los complejos de policistina estimulan a las cascadas de señalamiento intracelular que influyen en los genes de transcripción. Las evidencias sugieren que el complejo de policistina actúa como un sensor mecánico, recibiendo señales de la matriz celular (principalmente de adhesiones focales), células vecinas (a través de uniones celulares) y la luz tubular (a través de la cilia) y transductores con respuesta intracelular que regulan la proliferación, adhesión, migración, diferenciación, y maduración esencial para el control del diámetro de los túbulos renales y la morfología renal.
Fuente de información: Department of Medicine, Division of Nephrology, Mount Sinai School of Medicine, New York.
Clínica: La presencia de tremendos quistes agrandados es característica de PQRAD (Fig.14).
Varían desde unos milímetros a muchos centímetros y son de color claro o chocolate que sugiere hemorragia. Los riñones pueden exceder los 40 cm. de tamaño y pueden pesar hasta 8 kg.
La enfermedad es asintomática (14) en el 50 % de los casos. En general, los primeros síntomas aparecen en la tercera o cuarta décadas, y el mas temprano es la disminución de la concentración de la orina (Fig.15). En ausencia de Insuficiencia renal, la máxima osmolaridad urinaria es 16 % menor en adultos afectados que en miembros de la familia no afectados. 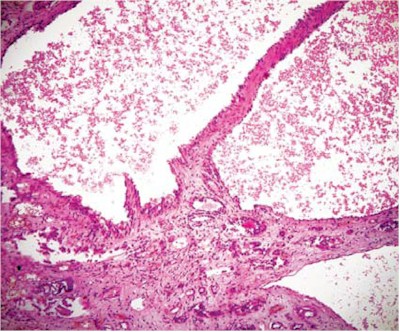
Fig. 14. PQRAD. En algunas áreas, los quistes pueden ser vistos como estructuras tubulares desplazadas (H&E, 200).
La hipertensión es la manifestación mas frecuente y el factor al que se le atribuye el deterioro de la función renal y el agravamiento de la insuficiencia renal ya establecida.
Otras manifestaciones clínicas (15) a considerar son la infección urinaria, hematuria macroscópica, cefaleas, poliuria, cólico renal, litiasis renal, pielonefritis, infección del quiste. 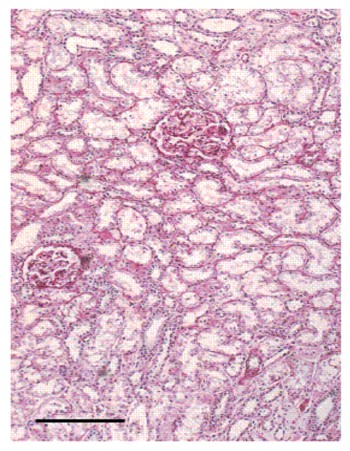
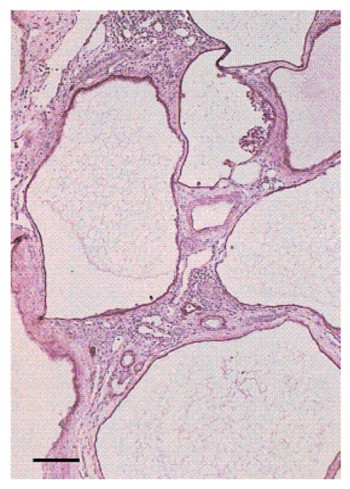
Figura 15. Pérdida del tejido renal en PQR. Se observan muchos glomérulos y túbulos (A). En contraste, se observan túbulos y glomérulos y múltiples quistes en riñones de pacientes con IRCT (B).
Las cefaleas que son severas o que parecen sentirse diferentes de otras cefaleas, podrían ser causadas por aneurismas o vasos sanguíneos dilatados en el cerebro. También podrían ser causadas por elevación de la presión arterial.
La infecciones del tracto urinario deberán ser tratadas con antibióticos porque podrían infectar a los quistes; siendo dificultoso su tratamiento a posteriori porque muchos antibióticos no penetran dentro de los quistes.
Ciertas funciones endocrinas solo parecen estar alteradas, con aumento de la renina y la eritropoyetina. El aumento de renina se relaciona con la hipertensión arterial.
Aunque la Policitemia es rara, el Hematocrito se mantiene mucho mejor en pacientes con fallo renal por PQRAD que en pacientes con otras formas de enfermedad renal, reflejando la presencia de altos niveles de eritropoyetina.
Existen anomalías quísticas (23) asociadas a esta enfermedad, como quistes hepáticos, pancreáticos, aracnoideos y ováricos; y no quísticas como divertículos en el colon, prolapso de la válvula mitral, aneurisma de la aorta abdominal o aneurismas intracraneales (que producen muerte súbita).
La presencia de poliquistosis hepática, agrega síntomas diversos que complican el cuadro.
Diagnóstico: Se realiza mediante ecografía. En caso de historia familiar positiva, el diagnóstico se establece (10) en función de la edad y del número de quistes.
En personas de menos de 30 años (26): dos quistes (unilaterales o bilaterales); pacientes entre 30 y 59 años: dos quistes en cada riñón; mayores de 60 años: al menos cuatro quistes en cada riñón.
Consejo genético: cada hijo de un padre afectado tiene el 50 % de probabilidades de presentar la enfermedad a lo largo de la vida. En general, padres convenientemente informados mediante consejo genético no alteran sus planes reproductivos por una enfermedad de comienzo tardío. Si embargo, en otros casos, no hay un adecuado conocimiento de la enfermedad y sus implicaciones y, como existe un largo período presintomático, el diagnóstico se realiza cuando ya tienen descendientes. Se recomienda el diagnóstico precoz en adultos con historia familiar mediante ecografía.
Tratamiento: Si el crecimiento de los quistes (16) juega un rol central en la progresión del fallo renal, cuando disminuimos el tamaño en quienes esto ocurre, podría preservar la función renal. Los bloqueadores de los canales de sodio como amiloride minimizarían la entrada de sodio y disminuirían o detendrían el crecimiento quístico. La colchicina, vinblastina y taxol pueden prevenir la formación de quistes in vitro. La metilprednisolona, la alcalinización urinaria y el lovastatin detienen el curso de la enfermedad renal, pero no se hicieron estudios significativos evaluables.
Debe instaurarse precozmente el tratamiento antihipertensivo para mantener cifras de presión arterial inferiores a 130-140/80-85 mmHg. Los fármacos de elección son los inhibidores de la enzima conversora de la angiotensina o los antagonistas de los receptores AT2 de la angiotensina.
Se debe indicar una dieta baja en proteínas (0,6 a 0,7 g/kg por día)
El efecto del embarazo (28) en mujeres con enfermedad renal poliquística adquirida (ERPQA) es variable, siendo la fertilidad similar a lo normal, las normotensas tienen embarazos no complicados, las hipertensas tienen un riesgo aumentado con fetos de bajo peso y preeclampsia.
Cuando existe fallo renal terminal, las opciones son hemodiálisis o trasplante renal porque la diálisis peritoneal es menos usada.
Mostramos el caso de una mujer de 45 años de edad con PQRAD con clínica urológica para consideración de nefrectomía bilateral por severo dolor y distensión abdominal (fig. 16). La RMN del abdomen (panel A) mostró un gran agrandamiento y reemplazo completo del hígado (flecha de arriba) y de los riñones (flecha de abajo) por quistes. Se realizó nefrectomía bilateral (panel B), con remoción del riñón izquierdo que midió 29 cm. por 20 cm. por 14 cm. (peso 3.100 g) y el riñón derecho midió 28 cm. por 14 cm. x 11 cm. (peso 1.600 g). Los riñones contenían quistes con 5 cm. de diámetro de tamaño. La paciente notó una inmediata mejoría en el dolor abdominal y una marcada disminución de la distensión abdominal. 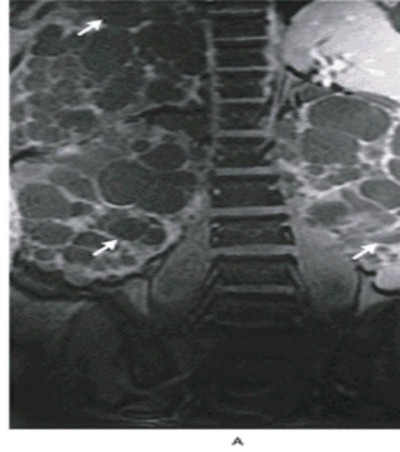
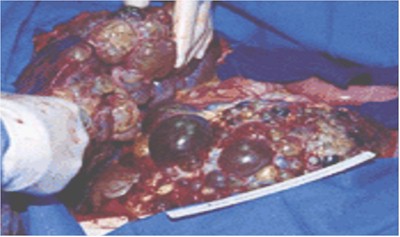
Figura 16. Panel A: Tomografía axial computada. Panel B: Nefrectomía bilateral.
NEFRONOPTISIS JUVENIL
Se trata de una nefritis (19) túbulo intersticial crónica hereditaria de carecer autosómica recesiva, caracterizada por quistes en la médula renal, trastorno del crecimiento y que progresa a la Insuficiencia Renal crónica terminal durante la adolescencia, que se distribuye por igual en hombres y mujeres.
La incidencia de esta enfermedad ha sido estimada ser de 9/8.3 millones de nacidos vivos en Estados Unidos de América y 1/50.000 nacidos vivos en Canadá, y fue descripta por primera vez en l945 y 1951.
Como en otras enfermedades renales genéticas (como PQRAD o nefritis hereditaria), la rapidez de la progresión al fallo renal está probablemente determinada en parte por el tipo y la severidad del defecto genético. Sin embargo, algunos datos sugieren que ocurre un fenotipo clínico e histológico claramente similar entre parientes con defectos genéticos diferentes. Porque no han sido identificados marcadores específicos, el diagnóstico se hace por inferencia de la historia familiar (si presenta), la poliuria y la disminución de la capacidad de concentración, análisis de orina relativamente normales, y la presencia de un contorno renal liso y riñones de tamaño normal o pequeños en la ecografía, en el urograma o en la TAC. En suma, La pruebas mas tardías a menudo muestran quistes múltiples pequeños y ocasionalmente grandes en la unión corticomedular.
|