Factores ambientales de riesgo, radicales libres y enfermedad. Revision 2.
Radicales libres y enfermedad.
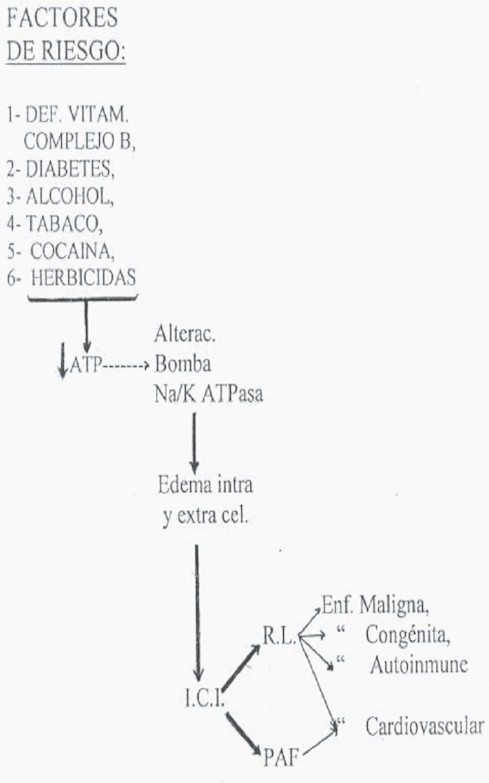
Los Radicales libres son átomos con un electrón célibe en su órbita externa, lo que les imprime una marcada inestabilidad y una gran reactividad que los hace muy tóxicos y muy oxidantes capaces de dañar de manera indiscriminada estructuras biológicas de las células por reacción en cadena de peroxidación. Cuando los sistemas enzimáticos defensivos son desbordados por una mayor producción de Radicales libres determinada por factores externos, se va a generar especialmente OH’, contra el cual no existe ningún mecanismo natural o enzimático de defensa, además de poseer una muy alta actividad oxidativa. Estos elementos van acumulando lentamente lesiones en sistemas biológicos celulares (1): proteínas, fosfolípidos de la membrana celular, ácidos nucleicos (ADN) (17), lipoproteínas de baja densidad o Colesterol (5), enzimas con grupos sulfhidrilos (Lisozima), mitocondrias, etc:
1- Los Radicales libres ocasionan lesión de peroxidación de las células proteicas estructurales como la elastina, el colágeno, el ácido hialurónico, etc, con alteración de sus propiedades biofísicas y bioquímicas (6). Promueven, además, enlaces cruzados mediados por grupos sulfhidrilos de algunos aminoácidos. Por acción de la proliferación de fibroblastos consecutiva a la actividad de los factores de crecimiento (mitógenos) y citocinas fibrogénicas producidos por los macrófagos se va instaurando fibrosis, esclerosis, angiogénesis y células musculares lisas, como se observa en la arterioesclerosis y las enfermedades autoinmunes. En los familiares encuestadas de los 360 pacientes y que vivían en las mismas condiciones de vida se encontró que el 38% presentaba alguna manifestación de enfermedad autoinmune (3).
2- Los Radicales libres, en particular el OH’, atacan los ácidos grasos polinsaturados fosfolípidos a nivel de los dobles enlaces carbono-carbono. Los ácidos grasos insaturados lesionados se convierten en Radicales libres con súbita restauración de sus dobles enlaces para formar un radical peroxi-ROO en presencia de O2 (2). De esa manera se forma una reacción en cadena, la lipoperoxidación (2), que termina cuando encuentra moléculas frenadoras. En el curso de estas reacciones se eliminan productos de degradación como los malondialdehídos que aumentan con la edad y que sirven para medir el daño por peroxidación lipídica (4,5). Este proceso determina una desorganización estructural, así la membrana pierde su textura y sus funciones de información y la permeabilidad selectiva con entrada de calcio para activar las enzimas catabólicas. Esta es la razón del punteado radioopaco observado a la sialografía en la Parotiditis recidivante y el síndrome de Sjögren cuando el medio de contraste ingresa a presión al acini (21). Además, esta lesión va demarcando un mayor envejecimiento.
3- Los Radicales libres oxidan las lipoproteínas de baja densidad (LDL) (5) infiltradas en la membrana celular y entre las células endoteliales, sufriendo precipitación con tendencia a formar placas de ateroma en las arterias escleróticas (5,22).
4- Los Radicales libres inhiben las enzimas con grupos sulfhidrilos (1,3), como la Lisozima. Por ello ella desempeña el papel de molécula barrendera, al igual que las vitaminas A, C, E, cisteína, glutatión, albúmina, etc (1,3). La Lisozima es básica en la activación del gen supresor para convertirlo en antioncogén o gen supresor tumoral (3).
5- El radical hidroxilo puede lesionar el DNA de una célula somática por mutación puntual para determinar una lesión maligna (3,23).
Para el control normal de la proliferación de las células se distinguen dos tipos de genes:
A- Los genes promotores o protooncogenes, encargados de promover la proliferación celular, son activados por la enzima DNA-polimerasa (1,3) y en caso patológico también por los factores de crecimiento. B- Los genes supresores que algunos llaman gen p53 (24-27) o reguladores de dicha proliferación, activados, como lo presumimos, por la Lisozima (3). El equilibrio entre estos dos tipos de genes mantiene una normal multiplicación celular. Los primeros son mejor conocidos desde cuando los nobel Arthur Kolberng y Severo Ochoa sintetizaron el DNA y descubrieron la DNA-polimerasa. Mientras los segundos apenas si se sospechan.
La Lisozima es una enzima básica de carga eléctrica positiva (28) constituida por una cadena polipeptídica de 129 aminoácidos, ocho de los cuales son moléculas de cisteína que por acción del radical O2- forman cuatro puentes disulfuro de cistina que le dan consistencia a la molécula enzimática y la mantienen plegada. Aquí los Radicales libres actúan favorablemente. Para su síntesis la Lisozima requiere ATP, para lo cual son indispensables las Vit. del complejo B. Aproximadamente el 40% de la cadena polipeptídica tiene una forma de segmentos alfa-helicoidales o secundaria, que dibuja una hendidura a un lado de la molécula y que constituye el sitio activo de la enzima. Su estructura secundaria es mantenida por enlaces de H entre un grupo amida situado en cierta posición y un grupo carboxilo (CO) situado por arriba o por debajo. El OH’ rompe esos enlaces para formar agua perdiendo la molécula su estructura secundaria con inhibición de la enzima.
La Lisozima actúa como regulador o ‘freno’ de la replicación del DNA o sea, como control de la multiplicación celular. Para ingresar a la célula debe despolimerizar el mucopolisacárido que constituye los receptores existentes en la membrana. Ella es captada por receptores proteicos del citoplasma que por fosforilación transducen sus efectos reguladores sucesivamente hasta el gen p53 del DNA del cromosoma 17 del núcleo de una célula somática (1,3,28). Así se activa este gen convirtiéndose en gen p53 salvaje, conocido como antioncogén o supresor tumoral. Este lleva la orden de controlar la replicación del DNA o sea de la multiplicación celular determinada por la DNA-polimerasa. Al disminuir la Lisozima, sea por deficiente síntesis de ATP por cualquier causa como la hipovitaminosis B o por acción inhibidora de los Radicales libres (OH’), se salta el freno con predominio del protooncogén activado por la DNA-polimerasa y los factores de crecimiento (3). En este caso puede suceder:
a- Dada la mayor actividad, de la DNA-polimerasa y los factores de crecimiento por la falta o disminución del ‘freno’ se va a generar una proliferación de células bien diferenciadas, normales, es decir, una hiperplasia del tejido afectado con características y producción de matriz intercelular (mucopolisacáridos) normales. Ello es debido a que el mRNA conserva la información del código genético. Así se produce el tumor benigno (3).
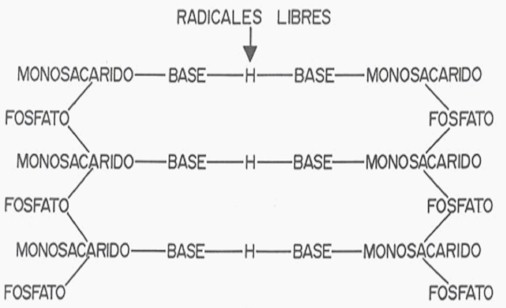
b- Si en lugar de este fenómeno se opera una mutación puntual del protooncogén por acción del OH’ (Fig. 3) producido en exceso durante la Inflamación Crónica Inespecífica o por acción de las radiaciones ionizantes, este protooncogén se va a convertir en oncogén con deleción parcial de una base complementaria, el código genético se altera inmediatamente y el mRNA, con su mensaje genético alterado va estimular el ribosoma para que codifique una proteína intercelular anómala, la oncoproteína. La proliferación celular va a ser irregular, sin un patrón, descontrolada; las mitosis más rápidas y las células muy indiferenciadas o anaplásicas en la medida en que el proceso es más agresivo, activados, a su vez, por los factores de crecimiento (mitógenos) y citocinas fibrogénicas, determinantes de angiogénesis y fibrosis, es el tumor maligno (1,3).
c- La tercera forma es una mezcla de las dos anteriores. La lesión comienza en forma de tumor benigno y si en el transcurso de un tiempo variable el protooncogén sufre una mutación puntual para convertirse en tumor maligno, ya descrito, como sucede en la malignización del tumor mixto de parótida, el bocio, el papiloma laríngeo. Sin embargo, el tumor benigno no necesariamente sufre malignización.
El oncogén producido por esta vía es lo que se denomina oncogénesis endógena o celular (c-onc), a diferencia de la exógena o viral (v-onc) que ocurre cuando al protooncogén se integra por mutagénesis insercional un virus oncógeno DNA de carga eléctrica negativa, como el papilomavirus (HPV) (28), con mutación puntual de dicho gen del fibroblasto. Cuando el virus oncógeno no se integra al DNA nuclear, da lugar a la Papilomatosis laríngea juvenil u otra lesión, permaneciendo latente en el soma del núcleo recibiendo el nombre de episoma, sin determinar malignidad, aunque puede sufrirla en cualquier momento favorable. No obstante, para que dicha integración al DNA se efectúe se requiere que exista una predisposición dada por deficiente nivel de Lisozima, porque ella con su carga eléctrica positiva inhibe extracelular o citoplasmaticamente al virus oncógeno de carga eléctrica negativa impidiéndole ingresar a la célula o integrarse al DNA nuclear, por lo que ella constituye el verdadero “guardián del genoma”. Así se explica por qué los agentes cancerígenos parecen selectivos al afectar a unas personas y no a otras. En nuestro estudio (3), las enfermedades malignas estuvieron presentes en un 31% de los familiares que convivían con los 360 pacientes con malformaciones congénitas. 15 pacientes con Papilomatosis laríngea tratados con dieta balanceada, Complejo B y Lisozima (28) se recuperaron.
6- Los Radicales libres pueden igualmente dar lugar a mutación del DNA de un gen cromosómico de una célula germinal, sea el espermatozoides o el óvulo (3,22) (Fig. 3). Ello da lugar a anomalías de carácter genético preconcepcional. Esta mutación es, en general, de tipo puntual (29), ocasionada por la acción oxidante del OH’ sobre el enlace de H que une las bases de las dos tripletas de un gen del DNA con deleción parcial. Se afecta una sola base complementaria, en la que se sustituye una base por otra, por ej. T por A. Esta mutación altera, en consecuencia, la información del código genético del gen al dificultar la transcripción en el DNA correspondiente con su mensaje genético y la generación de dismorfosis en la descendencia (1). Ello sucede así porque al llevarse a cabo la concepción ya lleva el error que se desarrolla en la blastogénesis durante el periodo de organogénesis o de diferenciación y migración celular que ocurre durante el primer trimestre del embarazo.
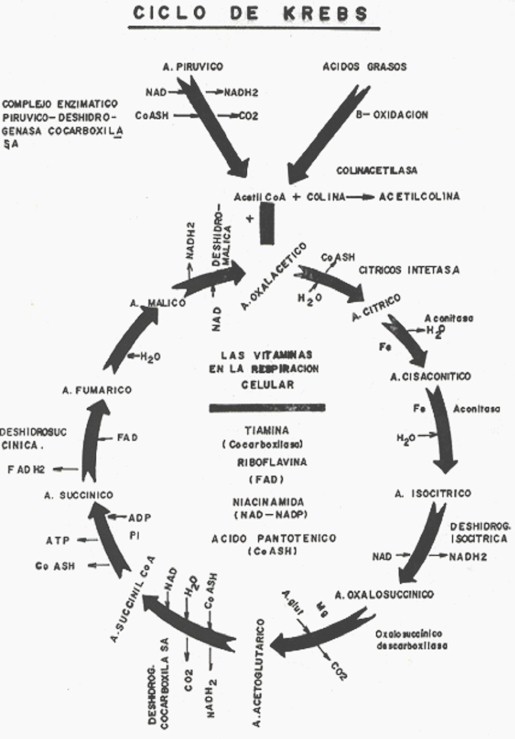
7- Las mitocondrias también comparten el edema intracelular en el proceso de la Inflamación Crónica Inespecífica. La persistencia de la acción inflamatoria va a determinar una lesión permanente de peroxidación de los Radicales libres sobre la misma mitrocondria a nivel de las crestas y matriz donde se realizan las reacciones del ciclo de Krebs y la fosforilación oxidativa. De esa forma, la mitocondria pierde su capacidad degradativa de la glucosa, por lo que esta aumenta en el plasma, dando lugar a la Diabetes-2, insulina-resistente que aparece en la vida adulta al fundirse la central eléctrica, la mitocondria.
Las anomalías postconcepcionales o embrionarias, son las que se producen por exposición de la gestante a algún factor teratógeno durante el período de organogénesis durante el primer trimestre de gestación. Las causas son diversas y las clasificamos en dos grupos: A- Metabólicas y B- Inflamatorias.
BIBLIOGRAFIA
1-Cotran, R.S. et al. –Patología Estructural y Funcional. 5ª. Ed. Mc-Graw-Hill Interamericana, Madrid, 1997.
2-Guyton, A.C. et al. –Tratado de Fisiología. 9ª. Ed. Mc-Graw-Hull Interamericana, México, 1997.
3- Altamar, J. –Herbicidas y Malf. Congén. en el Meta, Colombia. Actividad Patogénica de los RL. Orinoquia, Villavicencio, Colombia, 2002; 6: 9-35.
4- Villa Pérez, M. –RL de O2 y la Enfermedad. Conferencia en la VI Reunión del Grupo Español de RL. Cádiz, Junio 2002; 26-28 Junio 2002.
5- Jiménez, S. –Antioxidantes y RL en el Tabaquismo. Solo-Mujeres. Buenos Aires; 2003.
6- Southern, P.A. and Powis, G. –Medicine. II. Involvement in Human Disease. Mayo Clinic.Proc. 1994; 63: 390-404.
7- Altamar, J. –El Síndrome de Sjögren, una manifestación de deficiencia del complejo B. Anales ORL.Iber-Amer. 1985; 12: 443-457.
8- Green, P.H.R. –Alcohol Nutrition and Malabsort. Cl.Gastroen.N.A. 1983; 12: 563-574.
9- Lemoyne, P. et al. –Les enfants de parens alcoholiques. Anomalies observes. Quest. Med. 1968; 21 : 476-482.
10- Jones, K.L. –Pattrerns of malformation in offspring of chronic alcoholic mother. Lancet. 1973; 1: 1267-1271.
11- Palmer, R.H. et al. –Congenital malformation on offspring of a chronic alcoholic mother. Pediatrics, 1974; 53: 490-494.
12- Falcón, G. Et al. –Síndrome alcohólico fetal. Rev.Esp.Ped. 1980; 36: 35-42.
13- Ruiz, M. Et al. –Efectos tóxicos del tabaco. Rev.Toxicol. I.Canarias. 2004; 21:47-71.
14- Goodman y Gillman, L.S. –Bases Farmacologicas de la Terapéutica. 8ª. Ed. Edit. Panamericana, México, 1991.
15- De Ross, A. J. et al. –Cancer incidente among Glyphosate-Exposed Pesticida Applicators in the Agricultural Health Study. Enviromental Health Perspectives, 2005; 113: 49-54.
16- Ramírez D, W.F. et al. –Efectos del Glifosato con énfasis en organismos acuáticos. (Revisión de Literatura). Orinoquia. Villavicencio, Colombia, 2004; 7: 70-100.
17- Martins, M.A. et al –Interaction between inflammation and systemic haematologic Effect of PAF-acether in the rat. L.Pharmacol. 1989; 36:333-360.
18- Hilliguin, P. et al.-Correlation. Between PAF-acether and tumor necrosis factor in rheumat Arthritis. Influen. of parenter.corticoster. Scands. J.Rheumat. 1995; 24: 169-173.
19- Hollan, S. –FR in health and diseases. Haematologia. Budapest, 1995; 26: 177.
20- Alloati, G. Et al. –Role of PAF in oxygen radical.induced cardiac dysfunction. J. Pharmacol.Exp.Ther. 1994; 269: 766-771.
21- Altamar, J. –La Parotiditis recidivante. Su etiopatogenia y tratamiento. Anales ORL. Iber-Amer. 1994; 21: 391-402.
22- Hallivell, B. –Current review. Free reactive oxygen species human disease, a critical evaluation with special reference to aterosclerosis. B. Exp.Path. 1995; 70: 737-757.
23- Richard, J. –Fumar. Cigarrillo. Reduce los niveles del antioxidante paraoxonasa. Diario Médico, Mayo 2000.
24- Narayan, A. et al. –Dissimilar cell cicle responses alter y-irradiation and cisplatin treat. Treatment are induced by p53 in head and neck squamous cell carcinomas. In Lippert – Metast. In head and neck cancer. Proc. In 2nd.Inter.Symp. Marburg; January 25-27, 2001.
25- Mochon, A. et al. –La mutación p53: un fenómeno tardío en la oncogénesis de cabeza cuello. Anales ORL.Iber-Amer. 1998; 25: 433-446.
26- Bier, H. et al. –Assesment of p53 mutations in squamous cell carcinomas of the head and neck: the critical impact of applied methods. In Lippert, -Metst. In head and neck cancer. Proceed. In the 2nd Int.Symp. Marburg; January 25-27, 2001.
27- Gottschlich, S. et al. –p53 gene analisis cancer of unknown primary in the head and neck. In Lippert, BM. –Metast. In head and neck cancer. Proceed. Of the 2nd Int.Symp. Marbirg; January 25-27, 2001.
28- Altamar, J. –The role of Lysozime on etiopathogenesis and treatment on Juvenile laryngeal papillomatosis. Otolaryngol. Torino; 1998; 44: 17-2
29- Altamar, J. –Acalasia esofágica y mongolismo, papilomatosis laríngea y dermatomiositis. ¿Un origen común? Revisión. Anales ORL.Iber.Amer. 1997; 24: 551-563.
Dr. Jaime ALTAMAR RIOS*
*Especialista exjefe del Servicio de ORL. Hospital Departamental de Villavicencio, Colombia. Junio, 2007.