Índice de Corte (creatinquinasa (CK)-MB / creatinquinasa (CK) Total).
El índice de corte o Índice Relativo es NECESARIO para saber el origen orgánico de la elevación de las cifras de creatinfosfoquinasa (CPK)-MB.
Frente a un aumento de creatinfosfoquinasa (CPK)-MB, hemos de distinguir si éste es debido a una alteración del músculo esquelético o del miocardio.
Es decir, no hay una cifra de creatinquinasa (CK)-MB, que a partir de la cual podamos diagnosticar un Daño Miocárdico para todos los pacientes, ya que estos tienen diferente masa muscular.
En la actualidad, hay Cardiólogos que consideran que no se debe dosificar la creatinquinasa (CK) Total. Solo la creatinquinasa (CK)-MB masa. Esperamos que después de esta explicación comprendan que son necesarias las dos para establecer el Índice Relativo o de Corte.
Cada Centro Hospitalario, debe de establecer su propio Índice de Corte, por medio de los estudios de Historias Clínicas, en conjunto con los datos de Laboratorio.
LACTODESHIDROGENASA (LD, LDH).
La LD (EC. 1.1.1.27), LDH, L-lactato es una enzima, localizada exclusivamente en el citoplasma de la célula, que transfiere H+ (deshidrogenasa) y cataliza la oxidación reversible de L-lactato a piruvato.
Tiene un PM de 140000 daltons.
Sus isoenzimas conocidas son: LD1, LD2, LD3, LD4, LD5.
En nuestro Laboratorio se emplea la siguiente reacción (Sociedad Alemana de Química Clínica) para la determinación de la Lactodeshidrogenasa (LDH).
LD (suero del paciente)
Piruvato + NADH ¯ + H+ Û Lactato + NAD
Fundamento: La velocidad de disminución del NADH se mide fotométricamente y es directamente proporcional a la actividad de la LD en la muestra problema o control.
Muestra: Suero, plasma heparinizado o plasma EDTA.
Valores normales en adultos a 37 ºC: De 230 a 460 U/L.
Este enzima está compuesto por 4 cadenas polipeptídicas de dos tipos: H y M.
Las estructuras de LD-H y LD-M están determinadas por los loci situados en los cromosomas 12 y 11, respectivamente.
La Lactodeshidrogenasa (LDH) está presente en casi todas las células del organismo humano, principalmente en: hígado, miocardio, músculo esquelético y hematíes.
Estos tejidos muestran diferentes composiciones isoenzimáticas.
Pueden aislarse diferentes formas moleculares en el mismo tejido o en tejidos distintos. A estas diferentes formas moleculares las denominamos isoenzimas de la Lactodeshidrogenasa (LDH).
Hemos dicho que la Lactodeshidrogenasa (LDH) tiene dos tipos de subunidades: M y H.
Se diferencian por el contenido y secuencia de aminoácidos y pueden combinarse para formar 5 tetrámeros (isoenzimas), separables por electroforesis.
La subunidad M, se encuentra principalmente en el músculo – esquelético (“Muscle”) e hígado.
La subunidad H, se encuentra principalmente en el corazón (“Heart”).
Los tetrámeros son: M4, M3H, M2H2, MH3, H4.
Las isoenzimas son: LD5, LD4, LD3, LD2, LD1.
En general, los tejidos que muestran metabolismo aerobio revelan, predominantemente, isoenzimas de movimiento electroforético más rápido (LD1), con mayor número de subunidades H.
Los tejidos que muestran metabolismo anaerobio revelan, predominantemente, isoenzimas de movimiento electroforético más lento (LD5), con mayor número de subunidades M.
La proporción de enzimas varía de un tejido a otro. En el corazón, predomina la isoenzima LD1 (del 18 al 33% de la actividad de la Lactodeshidrogenasa (LDH) Total). En el hígado, en cambio, es mayoritaria la isoenzima LD5 (del 2 al 13% de la actividad de la Lactodeshidrogenasa (LDH) Total).
La LD2 representa un 28 a 40% de la actividad de la Lactodeshidrogenasa (LDH) Total. La LD3, del 18 a 30%. La LD4, del 6 al 16%.
Existe una LD-X, que se presenta en testículos y esperma.
Métodos de Determinación:
Determinación enzimática para la actividad total de la Lactodeshidrogenasa (LDH).
Para la dosificación de las isoenzimas se pueden utilizar métodos no inmunológicos (electroforesis) y métodos inmunológicos.
Mediante éste último se determina directamente la LD1, tras el tratamiento del suero por un anticuerpo dirigido contra la subunidad M de la Lactodeshidrogenasa (LDH), que elimina las isoenzimas LD2, LD3, LD4 y LD5
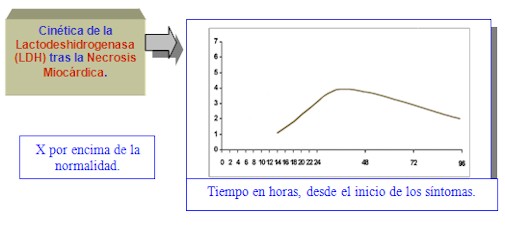
Tras la Lesión Miocárdica Mayor (IAM), la actividad de la Lactodeshidrogenasa (LDH) sérica aumenta menos rápidamente que la actividad de creatinquinasa (CK) Total, o la de la creatinquinasa (CK)-MB.
Comienza a elevarse a las 12 16 horas desde el inicio de los síntomas que exteriorizan el Daño Miocárdico.
Alcanza su máximo a las 30 a 40 horas.
Permanece elevada durante 10 a 12 días.
Por ello, es particularmente útil para el diagnóstico tardío, cuando el paciente es visitado suficiente tiempo después para que la creatinfosfoquinasa (CPK) Total y la AST sean normales.
La Troponina I, permanece elevada en suero, después del Daño Miocárdico, durante 7 a 9 días.
La Troponina T, permanece elevada en suero, después del Daño Miocárdico, durante 10 a 14 días.
Es decir, si se utiliza la Troponina T, no hará falta emplear la Lactodeshidrogenasa (LDH). Si se utiliza la Troponina I, si hará falta emplear la Lactodeshidrogenasa (LDH), para diagnosticar Síndromes Coronarios de un modo tardío.
En suero normal, la LD2 es mayor que la LD1 y el cociente LD1/LD2 es inferior a 1.
Tras Necrosis Miocárdica, la proporción de LD1 aumenta en comparación con las otras isoenzimas y el cociente LD1/LD2 es superior a 1 (LD invertida).
Cinética de la Lactodeshidrogenasa (LDH) tras la Necrosis Miocárdica.
GLUTÁMICO OXALACÉTICO TRANSAMINASA (GOT, AST).
La Aspartato Aminotransferasa (AST) (EC. 2.6.1.1), es una enzima de localización mitocondrial y citoplasmática que cataliza la transferencia reversible del grupo amino desde el aspartato al a-cetoglutarato.
El método de determinación que empleamos es:
AST
2-oxoglutarato + L-aspartato Þ Glutamato + Oxalacetato
MDH
Oxalacetato + NADH ¯ + H+ Þ Malato + NAD+
Fundamento: La velocidad de disminución del NADH (substrato) se mide fotométricamente (a 340 – 380 nm) y es directamente proporcional a la actividad de Aspartato Aminotransferasa (AST), en la muestra problema o control.
Métodos de Determinación: Método enzimático.
El contenido hístico de Aspartato Aminotransferasa (AST), de mayor a menos concentración, es:
- Cardíaco.
- Hepático.
- Músculo – esquelético.
- Riñón.
- Cerebro.
- Páncreas.
- Bazo.
- Pulmón.
- Eritrocitos.
Se encuentra elevada en suero (sangre), en las enfermedades hepáticas, necrosis miocárdica, necrosis del músculo – esquelético, distrofia muscular progresiva y dermatomiositis, pancreatitis aguda, embolia pulmonar, necrosis renal y cerebral, hemólisis, ejercicio físico intenso, después de la administración de opiáceos, salicilatos o eritromicina. Es normal en las enfermedades musculares de origen neurogénico.
En la Necrosis Miocárdica, se eleva a las 6 a 8 horas después del comienzo de los síntomas, alcanza el pico a las 18 a 24 horas y vuelve a la normalidad a los 4 a 5 días.
La Aspartato Aminotransferasa (AST) (GOT) no presenta ventajas sobre la creatinfosfoquinasa (CPK) y la Lactodeshidrogenasa (LDH): no es específica del miocardio y no aparece en la circulación de forma muy precoz.
Se debe abandonar el uso de la Aspartato Aminotransferasa (AST) como marcador de Lesión Miocárdica.
Resumen.
Desde hace tiempo, se sabe que la cantidad total (“área”) de las proteínas, no enzimáticas y enzimáticas, cardíacas, liberadas, guardan correspondencia con el tamaño del Infarto Agudo de Miocardio (IAM), mientras que la concentración máxima (“pico”) de la proteína mantiene solo un débil paralelismo.
La recanalización de una arteria coronaria obstruida (ya sea espontáneamente o por medios mecánicos o farmacológicos) en las primeras horas del infarto, hace que el “pico” de los marcadores séricos cardíacos aparezca antes y sea más elevado (aproximadamente a las 8 a 12 horas de la reperfusión).
El ascenso característico de los Marcadores Séricos se produce en todos los enfermos con IAM clínicamente (ECG con onda Q) demostrado.
Los niveles de creatinfosfoquinasa (CPK) Total y de creatinfosfoquinasa (CPK)-MB no suelen aumentar en la Angina Inestable.
Sin embargo, cerca de la tercera parte de los enfermos, que se cree padecen Angina Inestable a juzgar por la ausencia de la elevación de la creatinfosfoquinasa (CPK) Total y la creatinfosfoquinasa (CPK)-MB, presentan elevaciones de la Troponina T o Troponina I, muy sugerentes de “Microinfarto” o “Daño Miocárdico Menor”.
El hallazgo de una elevación de la Troponina, incluso ante valores normales de creatinfosfoquinasa (CPK) Total y creatinfosfoquinasa (CPK)-MB, sugiere un pronóstico desfavorable, por lo que debe considerarse que estos enfermos han sufrido un Infarto de Miocardio y se le debe tratar como tal.
Para confirmar el diagnóstico de certeza de Necrosis Miocárdica, los Marcadores Séricos Cardíacos deben medirse en el momento del ingreso del paciente en el Centro Hospitalario, a las 2 horas, a las 4 horas, a las 6 horas, a las 9 horas después y, de nuevo, a las 12 y 24 horas del ingreso sí el diagnóstico sigue siendo dudoso.