Revision bibliografica. Biologia molecular de leucemia mieloide aguda .1
Revisión bibliográfica. Biología molecular de leucemia mieloide aguda
Dra. Bismay Machado Cobas (1), Lic. Alexei Santana Galano (2), Dra. Mirley Vilató Floriam (3), Dr. Orlando Sanamé Columbié. (4)
1 Máster en Atención Integral a la Mujer. Especialista de I Grado en Medicina
General Integral. Asistente.
2 Licenciado en Bioquímica. Instructor.
3 Máster en Atención Integral a la Mujer. Especialista de I Grado en Medicina General Integral. Instructor.
4 Especialista de I Grado en Anatomía Patológica. Instructor.
Entidad: Filial Ciencias Medicas Baracoa. Guantánamo. Cuba
RESUMEN
La leucemia mieloide aguda es una neoplasia heterogénea. Las características bioquímicas de tal enfermedad son múltiples y diversas. Las aberraciones cromosómicas aparecen frecuentemente. El gen NPM1 aparece alterado en el 50% de los pacientes, mientras que el FLT3 es aberrante en hasta el 40% aunque éste último generalmente es sinónimo de mal pronóstico; existen otros genes mutados, los que le confieren una tasa replicativa mayor o una pérdida de la diferenciación potencial. Ninguna mutación por sí sola es capaz de convertir a una célula en leucémica sino que se requieren cambios adyuvantes. La mayor parte de estos cambios se correlaciona con un pronóstico.
Palabras clave: leucemia mieloide aguda, cáncer, tumor hemolinfopoyético.
INTRODUCCIÓN
La leucemia mieloide aguda (LMA) es una enfermedad difícil de tratar; afecta fundamentalmente a los adultos entre 15 y 39 años y constituye el 20% de las leucemias de la infancia. La leucemia mieloide aguda (LMA) es extraordinariamente heterogénea, reflejando las complejidades de la diferenciación de las células mieloides (la leucemia mieloide aguda (LMA), según la clasificación FAB revisada, agrupa 8 tipos de leucemias –M0 a M7-, y varios subtipos).
La leucemia mieloide aguda (LMA) es un proceso con múltiples pasos que involucran al menos dos tipos de mutaciones, las de clase I que activan las vías de transducción de señales confiriendo ventajas de proliferación sobre las células hematopoyéticas, y las mutaciones de clase II que involucran factores de transcripción y repercuten sobre la diferenciación celular.
En el presente trabajo nos hemos propuesto como objetivo brindar los principales elementos moleculares conocidos sobre la etiología de dicha enfermedad.
DESARROLLO
ALTERACIONES CARIOTÍPICAS
Las alteraciones cariotípicas aparecen en el 90% de los pacientes con leucemia mieloide aguda (LMA), aunque con las técnicas de tinción habituales generalmente es posible visualizar la mitad. Se han identificado una serie de alteraciones cromosómicas en pacientes con leucemia mieloide aguda (LMA). Entre ellas cabe destacar monosomías de los cromosomas 5 y 7, deleciones del brazo largo del cromosoma 5, anormalidades en el brazo largo del cromosoma 3, y otras anormalidades complejas. Se ha definido un cariotipo monosómico (CM) como de alto riesgo, el que involucra dos o más monosomías, así como una monosomía y otra aberración estructural; así mismo, se han definido grupos de bajo riesgo y riesgo intermedio, atendiendo fundamentalmente a la agresividad y resistencia de la enfermedad al tratamiento. No obstante, la razón molecular del por qué de este aumento del riesgo, permanece generalmente oscura.
Las leucemias mieloides agudas (LMA) que surgen de novo en los pacientes sin ningún factor de riesgo conocido suelen cursar con translocaciones cromosómicas equilibradas, mientras que aquellas que aparecen luego de un contacto con algún agente lesivo al ADN (como quimioterapia o radiaciones) suelen asociarse con deleciones o monosomías (ejemplo: cromosomas 5 y 7), y generalmente sin translocaciones. Sin embargo, aquellos agentes terapéuticos que inhiben la topoisomerasa II se asocian a translocaciones en 11q23, en el gen MLL.
OTRAS ALTERACIONES
Aproximadamente el 50% de los pacientes no presentan alteraciones cariotípicas visibles por las técnicas de tinción convencionales. Sin embargo, cada vez son más los genes que se asocian a la aparición y evolución de las leucemias mieloides agudas (LMA).
NPM1
Las mutaciones en el gen de la nucleofosmina 1 (NPM1) constituyen las mutaciones más frecuentes en aquellos pacientes sin aberraciones cromosómicas visibles, apareciendo hasta en el 50% de los pacientes con cariotipo normal, más abundante en la variante M4 y en células carentes de CD34. Son particularmente frecuentes en el exón 12 de dicho gen, todas afectando el C-Terminal de la proteína, identificándose hasta la fecha 14 variantes (todos mutantes heterocigóticos), con inserción de generalmente 4 pares de bases (pb), lo que produce un corrimiento del marco de lectura, y la sustitución de los últimos 7 aminoácidos por 11 diferentes residuos (los últimos cinco aminoácidos VSLRK, son comunes a todas las variantes), así como la sustitución de los triptófanos 288 y 290.
La proteína se localiza normalmente en el nucleolo, y se explica la presencia anormal de NPM1 en citoplasma por la presencia de una secuencia señal (como resultado de las mutaciones) de exportación del núcleo. La mutación de NPM1 es más común en mujeres (sobre el 60%).
Las funciones de NPM1 incluyen:
a) Interactúa con p53 controlando la proliferación celular y la apoptosis.
b) Ayuda a mantener la estabilidad genómica controlando la reparación del ADN y la duplicación de los centrosomas durante la mitosis.
c) Controla la biosíntesis de ribosomas.
Lógicamente, mutantes defectuosos de NPM1 afectarán el ciclo celular. NPM1 forma parte de un nuevo grupo de genes que pueden actuar como oncogenes o genes supresores tumorales. Sin embargo, su expresión sin FLT3 favorece un buen pronóstico.
FLT3
Aproximadamente un tercio de los pacientes afectados por leucemia mieloide aguda (LMA) tienen mutaciones en el gen FLT3, pudiendo clasificarse esta mutación dentro de la clase I.
El gen FLT3 codifica para un receptor, perteneciente a la clase III de la familia de receptores tirosina quinasa; posee 993 aminoácidos (aa), y un peso molecular de158/160 kD, está glicosilado (la variante no glicosilada no se asocia a membrana y pesa 130/143 kD), su locus aparece en 13q12, poseyendo 24 exones. El ligando de FLT3 (FL) es una proteína de membrana de tipo 1, con 235 aa, repartidos en un péptido señal hacia el N Terminal, cuatro dominios helicoidales extracelulares, regiones espaciadoras y regiones bisagra, un dominio transmembrana y un corto dominio citoplasmático. FL aparece en muchos tejidos, incluyendo aquellos que componen órganos hematopoyéticos, con los niveles más altos de expresión en células mononucleares de sangre periférica.
La unión de FL a FLT3 provoca una autofosforilación del receptor en residuos de tirosina, creando sitios de unión para moléculas efectoras y diversas vías de señalización. El dominio citoplasmático de FLT3 se une a la subunidad p85 del fosfoinositol 3 quinasa (PI3K), RAS GTPasa, fosfolipasa C-γ, Shc, Grb2 y proteínas quinasas de la familia Src; como resultado, estas proteínas son fosforiladas; posteriormente resultan afectadas las vías que involucran PI3Kproteína quinasa B (Akt) y la proteína quinasa activada por mitógeno (MAPK) (Figura 1). Es de esperar que, dado el papel que desempeña FLT3 en la expresión de proteínas y en el ciclo celular, la afectación del receptor, tenga efectos fisiológicos profundos.
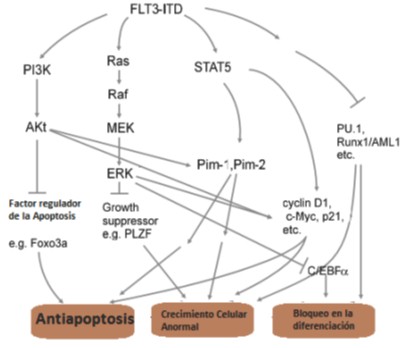
Figura 1. Mecanismos mediante los cuales FLT3 induce la oncogénesis leucémica. (Tomado de Takahashi S., Downstream molecular pathways of FLT3 in the pathogenesis of acute myeloid leukemia: biology and therapeutic implications. J. Hematol. Oncol. 2011, 4:13).