Impacto de Hormona Somatostatina y Analogos Radiomarcados en Diagnostico de Tumores Malignos.2
Más tarde, se reporta el empleo de fragmentos de AcMo altamente específicos (scFvs, 25 kDa; dímeros de scFvs, 55 kDa, etc).9 Éstos al poseer pesos moleculares más pequeños exhiben aclaramiento sanguíneo más rápido, distribución tisular más homogénea, mayor captación en tumor, recidivas locales y metástasis, con respecto a la molécula intacta del AcMo,10 posibilitando mejorar la relación tumor/ no tumor. No obstante, aún poseen un peso molecular de varios miles de Da que limitan su penetrabilidad tumoral principalmente en la detección precoz de lesiones pequeñas y micrometástasis.
A fines de la década de los ochenta, el descubrimiento de ciertos tipos de tumores que sobre-expresan receptores por ciertas hormonas peptídicas reguladoras, así como la alta afinidad y especificidad de las mismas por estos receptores; condujeron al desarrollo de unidades de reconocimiento molecular aún más pequeñas: Péptidos (peso molecular <5,5 kDa)11 de rápido aclaramiento sanguíneo. Igualmente, el advenimiento de métodos automatizados para la síntesis, purificación y caracterización de estos compuestos en grandes cantidades, contribuyó a un desarrollo comercial acelerado y consecuentemente a una explosión en el número de péptidos potencialmente útiles.12 Si bien los mismos ofrecen numerosas ventajas, existe una variedad de obstáculos que pueden entorpecer el desarrollo de los mismos. Los péptidos usualmente poseen menos de 50 aminoácidos y peso molecular < 5,5 kDa.11 Un péptido con bajo peso molecular exhibe baja antigenicidad, rápido aclaramiento sanguíneo y rápida penetración tisular y tumoral.13,14 Sin embargo, a medida que el tamaño se aproxima a los 5,5 kDa, las moléculas peptídicas mayores difunden más lentamente al interno del tumor y pueden ser altamente susceptibles a la proteolisis. Por otra parte, para acoplar un radionúclido con propiedades diagnósticas y/o terapéuticas, se emplea un agente quelante bifuncional (BFCA), cuyo peso molecular de ~ 300 Da comparable al del péptido al cual es enlazado, puede distorsionar la conformación peptídica, y por ende afectar el enlazamiento al órgano blanco15 o alterar su distribución in vivo.16 Por tanto, el BFCA debe ser acoplado de modo tal, que no interfiera con el reconocimiento del péptido por su receptor, Ej.: introducción de la marca a distancia del sitio de enlazamiento o de aminoácidos espaciadores entre el péptido y el BFCA.17,18
La mayoría de los péptidos endógenos tienen un tiempo de vida media biológico demasiado corto para su empleo con fines oncológicos, debido generalmente a su rápida degradación in vivo y sus múltiples acciones. Las enzimas usualmente poseen funciones muy bien definidas tales como: degradación del C- o N-terminal (exopeptidasas) o ruptura del enlace entre los L-amino ácidos (endopeptidasas). Por tanto, transformaciones estructurales tales como: uso de D-aminoácidos, modificación de aminoácidos terminales, ciclización, substitución de enlaces peptídicos, reemplazo de grupos aminos por grupos iminos; empleo de péptidos miméticos, aminoácidos o cadenas laterales inusuales, moléculas no-peptídicas con configuración similar, así como del fragmento (sitio de reconocimiento) que enlaza al receptor, si se conoce previamente el sitio susceptible a la ruptura; pueden reducir la degradación enzimática in vivo de la molécula peptídica, aunque pueda verse afectada su habilidad para enlazar al receptor específico sobreexpresado en tumor.19
Este documento ofrece una detallada revisión sobre la evolución de novedosos agentes diagnósticos basados en moléculas peptídicas marcadas, las cuales se encuentran comercialmente disponibles o en ensayo clínico.
Somatostatina y sus Análogos
La Somatostatina (SST) es una hormona peptídica cíclica de 14 aminoácidos (Fig.1) y peso molecular 1,6 kDa, aislada del hipotálamo ovino.20 Esta se encuentran distribuida ampliamente en el organismo, especialmente en el sistema nervioso central y periférico, sistema digestivo y glándulas endocrinas. Interviene en un amplio espectro de acciones biológicas supresoras sobre la fisiología normal de diferentes órganos a nivel celular Ej.: neurotransmisión, neuromodulación, liberación hormonal de la hipófisis anterior y glándulas periféricas; secreción de factores de crecimiento; proliferación celular y procesos de angiogénesis. Su efecto inhibitorio sobre la secreción hormonal de varias glándulas infiere sus posibles efectos beneficiosos en el manejo de patologías relacionadas con la hiperfunción de glándulas o sobreproducción de hormonas por tumores neuro-endocrinos activos.21 Cinco subtipos de receptores de la somatostatina (SSTRs: ssrt1, sstr2, sstr3, sstr4 y ssrt5), han sido identificados; estas glicoproteínas aparecen en células del tracto gastrointestinal, el sistema nervioso central, e incluso en células del sistema inmune.22,23 Estudios revelan sobre-expresión de dichos receptores de la somatostatina (SSTRs) en un gran número de tumores primarios humanos y sus metástasis con respecto a los tejidos sanos: tumores neuroendocrinos, cáncer de mama, pulmón, sarcoma, próstata, etc.24 No obstante, la somatostatina no ha sido efectiva por su corto tiempo biológico en circulación (2-3 min), debido a posibles efectos de rebote hormonal; su rápida degradación enzimática y sus múltiples funciones.21
A fines de los setenta, se reporta la síntesis y evaluación de análogos de la somatostatina 22-24 más resistentes a la acción de las enzimas peptidasas; sintetizados a partir de modificaciones en su estructura. (Fig.1). Estas transformaciones le confieren al péptido mayor estabilidad y tiempo de vida in vivo (2-3 horas) y preservan la actividad biológica de la molécula original; no obstante, pueden afectar el grado de afinidad de los análogos por los cinco receptores de la somatostatina.24 Así, en 1979, se sintetiza el primer análogo de la somatostatina, Octreotide (OC)25 mediante la reducción del tamaño molecular de 14 a 8 aminoácidos, introducción de un aminoácido D-Fenilalanina N-terminal, intervención en el enlace peptídico del grupo amino-alcohol-Treonin(ol) proveniente del aminoácido Treonina C-terminal y substitución en el sitio de reconocimiento ligando receptor del L-Triptófano por su D-isómero. El Octreotide se enlaza con alta afinidad a sstr2, con relativa baja afinidad a ssrt3 y ssrt5 y no reconoce a ssrt1 y sstr4.25
Más recientemente, se obtiene el Octreotate (Oc-ATE), mediante el reemplazo del grupo alcohol en el carboxilo terminal del Octreotide por un grupo ácido carboxílico para incrementar la afinidad por el sstr2, ya que este receptor se encuentra altamente expresado en ciertos tumores malignos. El Oc-ATE enlaza con mayor afinidad a sstr2 que el Octreotide, pero muestra una reducción en su reconocimiento por el resto de los receptores de la somatostatina. 26
Estudios in vitro con el análogo Vapreotide (RC-160), reportan mayor afinidad por los ssrts en cáncer de mama, ovario, páncreas, colón y próstata que el Octreotide. El RC-160 no marcado atraviesa la barrera hematoencefálica, en contraste con el Octreotide; lo cual permite emplear el RC-160 marcado en la visualización de tumores y metástasis cerebrales que contengan receptores de la somatostatina.27 Asimismo, otro derivado que ha suscitado creciente interés, es el Lanreotide. Este posee afinidad moderada por ssrt2, ssrt3, ssrt4, sstr5 y no enlaza a ssrt1.28
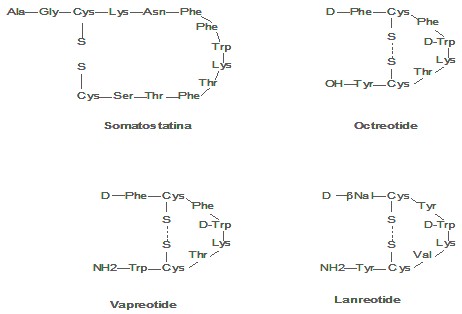
Fig.1. Somatostatina y varios de sus análogos.