Estudio de 5 casos duplicacion cromosomica y relacion con fenotipo que presentan pacientes .2
2.2 Cultivo de linfocitos de sangre periférica
El análisis citogenético, se realizó mediante el cultivo a corto plazo de linfocitos de sangre. Se extrajo sangre venosa del antebrazo en un tubo de heparina de litio. En cada tubo se sembraron 15 gotas de sangre completa con medio de cultivo: RPMI-1640 (Roswell Park Memorial Institute) (Gibco BRL, Grand Island, NY) suplementado con 20% de suero bovino fetal (SBF), 200mM L-glutamina, 1% de antibióticos y 1% de fitohemaglutinina (Gibco BRL). Las células se incubaron a 37ºC durante 72 horas para luego proceder al sacrificio del cultivo para la extracción de cromosomas.
Para detener las células se añadió a cada tubo Colcemid 0.02 µg/mL (Gibco, BRL) y se incubó durante 75 min a 37ºC. Posteriormente, se sometió a las células a un choque hipotónico para hincharlas y permitir la separación de los cromosomas, mediante la incubación con 0.075 M de KCl a 37ºC durante 20 min. Seguidamente, se fijaron las células con varios lavados de solución de Carnoy (ácido acético/metanol, 1:4). Los tubos con los sedimentos celulares se conservaron en congelador a -20ºC, hasta su utilización. Por último, se realizaron las extensiones cromosómicas.
2.3 Bandas G (tripsina-Giemsa)
Se trataron las extensiones con una solución de Tripsina-EDTA 0.25% (Gibco, BRL) en PBS, y se tiñeron con colorante Giemsa al 10% en tampón McIlvaine a pH 6.8. Tras la observación microscópica, se contaron diversas metafases y se procedió a la elaboración del cariotipo. Para elaborar dicho cariotipo, se ordenaron entre 5 y 8 metafases y finalmente se formularon según la nomenclatura ISCN (4).
2.4 Bandas prometafásicas
Esta técnica se utilizó para obtener mayor número de bandas y poder determinar mejor los puntos de rotura. Se sembraron 0.3 mL de sangre en 5 mL de medio T-199 suplementado con 10% de SBF + 1% de antibióticos + 1% de L-Glutamina y 1.2% de fitohemaglutinina. Durante 48 horas se incubó a 37ºC y transcurrido este tiempo, se le añadió 0.1mL de solución de methotrexate (O.2mL de MTX, 25µg/mL, en 100mL de agua estéril) y se incubó durante 16 horas (7). Posteriormente, se cultivaron en 5 mL de medio completo y 0.1 mL de solución de timidina (24.22 mg de timidina + 100 mL de agua estéril). Tras 5 horas, se procedió al sacrificio de los cultivos y a la realización de las bandas G, tripsina-Giemsa.
2.5 Hibridación “in situ” por fluorescencia (FISH): pintado cromosómico
Para la realización del pintado cromosómico, las extensiones envejecidas 24 horas, fueron pretratadas en 2xSSC a pH:7 a 37ºC durante 2 min y deshidratadas con diluciones de etanol a concentración creciente. Se prepararon las sondas para ponerlas en contacto con las muestras y se incubaron a 37ºC durante 16 horas. Se realizó contratinción con DAPI. La observación se realizó en el microscopio de fluorescencia Zeiss Axioplan 2 (Carl Zeiss Meditec Iberia, Madrid, España). Las sondas utilizadas fueron: de pintado cromosómico: Spectrum Green (SG): WCP4SG, WCP8SG, y Spectrum Orange (SO): WCP7SO, WCP9SO, y WCP10SO (todas de Vysis). La sonda telomérica: ptel08P-R (QBiogene) y la sonda combinada MD 10p14 / SE10 para el cromosoma 10 (Kreatech)
3. RESULTADOS
3.1 Estudio citogenético
De los 10.478 pacientes a los que se realizó el estudio citogenético, 5 fueron portadores de duplicación cromosómica (0.048%). Los resultados citogenéticos (fórmula cromosómica y estudio familiar) y la patología asociada quedan recogidos en la tabla 2. En todos los casos se afectaron los autosomas (5/5). El 60% fueron mujeres y el 40% varones. En tres casos la duplicación fue directa y en tándem, y en dos de ellos el material genético duplicado estaba invertido. Todas las duplicaciones fueron de novo, excepto una de ellas, que fue heredada de la madre.
Tabla 2

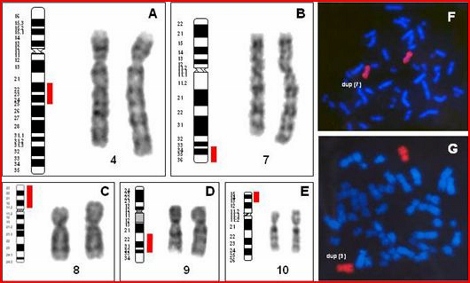
Caso 1. Duplicación 4q. El estudio del paciente se solicitó por abortos espontáneos de repetición. El cariotipo con bandas G y prometafásicas mostró la presencia de una duplicación en el cromosoma 4 del fragmento comprendido entre q22 y q24 (fig. 2A). El estudio familiar reveló en la madre la misma anomalía.
Caso 2. Duplicación 7q. El estudio de la paciente se realizó a los 2 meses de edad y fue solicitado dada la presencia de orejas puntiagudas, hiperplasia cerebelosa y ventrículos dilatados. El cariotipo con bandas G presentó duplicación de material cromosómico en los brazos largos del cromosoma 7 (fig. 2B y 2F). El estudio familiar realizado mostró en ambos padres cariotipo normal, por lo que esta anomalía se produjo “de novo” en la paciente.
Caso 3. Duplicación 8p. El paciente para el que se solicitó el estudio fue un varón de 7 meses de edad con asimetría en miembro superior izquierdo y en los orificios nasales, así como implantación baja de los pabellones auriculares. El cariotipo del paciente presentó una anomalía estructural en el cromosoma 8, consistente en una duplicación invertida del fragmento comprendido entre p.11.2 y p23.1 (fig. 2C y 2F). Se produjo también la pérdida del telómero 8p, confirmada por la técnica de hibridación in situ por fluorescencia (FISH) mediante la sonda específica de esa región ptel08P-R. Con la utilización de la sonda de pintado completo, CP5608GW, el cromosoma anómalo hibridó en toda su longitud confirmando que todo el material correspondía al cromosoma 8. El estudio familiar reveló que la anomalía era de nueva aparición.
Caso 4. Duplicación 9q. La paciente fue remitida a los 15 meses de edad por retraso psicomotor y pondoestatural (peso y talla
Caso 5. Duplicación 10p Se solicita el análisis citogenético a la paciente de 6 años de edad. Presentaba retraso psicomotor, que afectaba especialmente al área de lenguaje y pie izquierdo con tendencia de desviación hacia adelante. La paciente había padecido episodios convulsivos febriles hasta los dos años, además de un episodio afebril aislado.
Para determinar con mayor precisión los puntos de rotura, se realizó la tinción de bandas G en placas prometafásicas, lo que estableció que el segmento duplicado afectaba a las bandas 13-15 de los brazos cortos de un cromosoma 10 (fig. 2E). Esta anomalía se confirmó por hibridación in situ por fluorescencia (FISH), con sonda de pintado cromosómico que confirma que todo el material del cromosoma corresponde al cromosoma 10, y mediante sonda del locus 10p14, encontrándose una doble señal para el sitio 10p14. El estudio familiar también muestra que la duplicación es de nueva aparición.
Figura 2
4. DISCUSIÓN Y CONCLUSIONES
La incidencia de duplicaciones en el estudio realizado ha sido de un 0.48‰ sobre el total de cariotipos estudiados. Esta baja incidencia, que coincide con la referida por otros autores, hace que la duplicación cromosómica pertenezca a la categoría de enfermedades raras que, como es sabido, son de difícil caracterización y pronóstico. Además, hay que considerar que las duplicaciones, al igual que otras alteraciones estructurales de los cromosomas, pueden afectar desde fragmentos compuestos por un número pequeño de bases hasta grandes segmentos cromosómicos, lo que dará lugar a repercusiones fenotípicas muy variadas. De los casos que presentamos, sólo uno de ellos se encuadra en un síndrome determinado: se trata de la duplicación invertida y con deleción distal del brazo corto del cromosoma 8 (2), si bien el fenotipo presenta variaciones de unos niños a otros.