Aspectos basicos de la fisiopatologia de la enfermedad cerebrovascular isquemica para alumnos del ul
Nota informativa: El presente artículo no aspira a ser una revisión bibliográfica exhaustiva sobre la fisiopatología de la Enfermedad Cerebrovascular Isquémica, solo una comunicación breve de elementos básicos, con el objetivo de recordar rápidamente los conocimientos adquiridos sobre la misma, muy útil para ilustrar al estudiante de medicina sobre los puntos más elementales que debe dominar al respecto en la práctica preprofesionalizante del último año de su carrera.
La enfermedad cerebrovascular es uno de los motivos más frecuentes de asistencia médica urgente, constituye la tercera causa de mortalidad en el mundo desarrollado (12-15%) y la primera causa de discapacidad de origen neurológico en la población adulta (aproximadamente 30-40% de los que sobreviven, mantienen una incapacidad importante), con un gran impacto económico y social. De todos los casos, el 80-85% tiene un origen isquémico (1,2,3)
ANATOMIA VASCULAR CEREBRAL
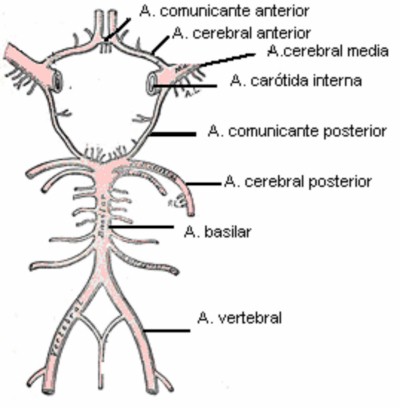
Está compuesta por una circulación anterior o carotídea que aporta el 70% de la irrigación cerebral (dos tercios anteriores de los hemisferios cerebrales) y una posterior o vertebrobasilar que aporta el 30% de la irrigación cerebral (tercio posterior de los hemisferios cerebrales, gran parte de los tálamos, tronco encefálico y cerebelo). La carótida interna después de perforar la duramadre emite sus ramas principales, la arteria oftálmica, comunicante posterior, coroidea anterior, cerebral anterior y cerebral media. De la porción extracraneal de las arterias vertebrales nacen ramas musculares que facilitan la circulación colateral en caso de oclusión del tronco principal; de la porción intracraneal nacen las arterias espinales anteriores y posteriores, la arterias cerebelosas posteroinferiores, y pequeñas ramas directas a la porción lateral del bulbo. De la arteria basilar nacen las cerebelosas anteroinferiores, cerebelosas superiores y las cerebrales posteriores. (3,4)
A nivel de la base del cerebro se establecen anastomosis de los ejes vasculares de estos dos sistemas formando el polígono de Willis (comunicante anterior, comunicantes posteriores, carótidas internas, cerebrales anteriores y posteriores), que en individuos normales favorece la circulación colateral. Desafortunadamente el polígono de Willis es un lugar de asiento frecuente de anomalías congénitas (la configuración descrita por Willis solo esta presente en el 20% de las personas, siendo más habitual la presencia de una hipoplasia en algún segmento arterial o que la cerebral posterior tenga un origen fetal y nazca de la carótida interna) y placas de ateroma. El resto de las anastomosis carecen de importancia protectora frente a un infarto. (3,4)
La mayoría de los vasos perforantes que irrigan el parénquima cerebral (territorio profundo) son arterias terminales sin colaterales, por tanto su oclusión provocara siempre un infarto. (3)
FISIOPATOLOGIA
En condiciones normales, el cerebro utiliza el 20% de todo el oxígeno, a pesar de representar el 2% del peso corporal total y mantiene un flujo cerebral global de unos 50-55 ml/100 g de tejido/min (15% del gasto cardíaco), con presiones de perfusión cerebral entre 50 y 150 mmHg. Es un órgano que puede tolerar bien presiones de perfusión cerebral tan bajas como 30 mmHg, flujos menores de 15 ml/100 g/min (otros refieren 15-20ml/100g/min), y presión parcial de oxígeno en sangre venosa cerebral de 20mmHg (aunque se produce una ausencia de actividad eléctrica que se traduce en una inactividad funcional neuronal pero que es potencialmente reversible si se restablece la irrigación). Cuando el flujo se reduce por debajo de 10ml/100g/min (para algunos entre 10-15ml/100g/min) se producen alteraciones electrofisiológicas en la membrana celular y muerte neuronal, y puede también provocar perdida axonal parcial, incluso de las terminales presinápticas, en las neuronas que sobreviven. (3, 5, 6,7, 8.)
Al producirse la oclusión vascular tiene lugar una cascada de eventos bioquímicos producidos por una interacción dinámica entre neuronas, astrocitos, fibroblastos, células musculares lisas y endoteliales, que a su vez interactúan con los elementos formes de la sangre y conllevan a la muerte celular. (9)
Durante unos pocos minutos después de iniciado el proceso, las neuronas mantienen un metabolismo anaeróbico que produce ácido láctico y reduce el pH intra y extracelular (acidosis), lo que combinado con la depleción energética, determina la despolarización de las membranas (la hipoxia origina el desacoplamiento de la fosforilación oxidativa, lo que trae consigo la disminución del ATP y otros nucleótidos energéticos). La cantidad de ácido láctico formado depende de la cantidad de depósitos tisulares de glucosa y glucógeno. La persistencia de hiperglicemia ocasiona una excesiva acidosis que agrava el daño cerebral, debido a la producción de radicales libres, liberando el hierro pro-oxidante a partir de proteínas como la transferrina y la ferritina. (3,10,11,12,13)
La despolarización de las membranas produce daño a la bomba de Na+ K+ ATPasa dependiente, lo que se traduce en la salida del K+ de la célula, aumento de la liberación de grandes cantidades de glutamato (y otros neurotransmisores) lo que estimula los receptores ionotrópicos, fundamentalmente el AMPA y NMDA, así como receptores metabotrópicos. La estimulación del receptor AMPA conlleva al acúmulo citosólico de Na+ y agua y ocasiona edema cerebral, y la estimulación del receptor NMDA junto a la apertura de los canales de Ca2+ dependientes de voltaje (sensibles a las dihidropiridinas), origina una entrada masiva de Ca2+ con un incremento de la concentración intracelular de aproximadamente el doble de su valor inicial, lo que constituye el factor clave en el proceso que conduce al daño cerebral irreversible. El funcionamiento de los canales de Ca2+ se mantiene en casos de isquemia moderada (área de penumbra isquémica y reperfusión), cuando la isquemia es muy grave, ambos tipos de canales se inactivan. (3,10,14)