Toxicos ambientales y salud. Intervencion educativa .3
En el medio ambiente los metales pesados debido a sus configuraciones electrónicas son capaces de adsorberse en material particulado, en medio acuoso son capaces de combinarse de distintas formas con entidades químicas diversas, entre ellas: ácidos húmicos, sulfatos, sulfuros e hidrogenosulfuros, carbonatos e hidrogenocarbonato, amoníaco disuelto, oxidrilos, halogenuros, nitritos, aminas, grupos alquilos y arilos y otras partículas orgánicas que hacen de ellos un grupo de extraordinaria diversidad y bioasequibilidad. Son transformados por microorganismos y otras especies que colaboran en su forma de presentación al medio: bioalquilación que le imprime mayor volatilidad que al metal solo y mejor bioasimilación.
Cd (Cadmio)
Considerado por la EPA (Evironmental Protection Agency) como un metal cancerígeno. Se acumula en concentración de 40µg/día, una persona de 40 a 60 años puede llegar a contener 300 mg de Cd, la mitad del mismo en el hígado y el riñón.
Los cigarrillos constituyen una importante fuente de Cadmio para el hombre. 20 cigarrillos por día pueden acumular hasta 40µg de Cd por vía oral. Cantidades considerables pueden ser incorporadas al organismo a través de alimentos de origen animal y en las bebidas tiene efecto sinérgico en la absorción cuando hay baja proporción de Fe en sangre y deficiencias de proteína.
Una vez en el organismo se concentra principalmente en el hígado y riñones en menor medida en el páncreas y glándulas salivales. La principal vía de excreción es la orina. Los síntomas de intoxicación por cadmio incluye: nauseas, salivación, vómitos, dolores abdominales, dolor de cabeza, etc. La ingestión de cantidades considerable de Cd deforma el esqueleto humano y produce dolores intensos. En ocasiones cáncer en próstata, pulmón y cáncer en general.
Cobre (Cu)
El cobre es un metal de alta toxicidad para las plantas acuáticas ya se observan síntomas de inhibición del crecimiento a concentraciones inferiores a 0,1 mg/l. Las algas verdes-amarillas son muy sensibles a la presencia del cobre, dificultando la fijación de nitrógeno. La toxicidad del cobre para las plantas disminuye si existen agentes complejantes en el entorno hídrico.
Para los invertebrados (de agua dulce y salobre) el cobre es muy tóxico. En determinadas condiciones el efecto letal del cobre (muerte del 50% de la población considerada) se observa ya en concentraciones de 0,006 mg/l siendo la toxicidad mayor en agua dulce que salobre.
El cobre para peces de agua dulce generalmente es más tóxico que otros metales pesados, excluyendo al mercurio. La magnitud de la dosis letal (LD50) en dependencia del medio se mueve entre 0,017-1mg. Pero un aumento en la dureza del agua puede aumentar la dosis letal (LD50) hasta 3mg/l. Para los peces marinos la capacidad de complejar el cobre por las sustancias disueltas disminuye la toxicidad del cobre para peces marinos. Se ha observado que el 30% de algunos peces en 96h mueren por la acción de 8mg/l de Cu. En agua dulce las especies más tóxicas del Cu son: Cu2+ CuOH+, Cu2 (OH)22+. Por su acción conjunta, la dosis letal para 96h de exposición LD50 se mueve entre 0,00009-0.23 mg/l. Con una dureza de 12mg/l la concentración letal para algunas clases de peces se eleva hasta 10-50 mg/l
Humanos
El cobre para el ser humano no es un tóxico agudo. El cobre pocas veces se enlaza con proteínas con grupos que contienen azufre. En algunos casos el déficit de cobre en el organismo simula una intoxicación crónica para la persona que la padece. No se han establecido en el cobre propiedades mutagénicas ni cancerogénicas.
Arsénico
Los efectos tóxicos del arsénico y sus compuestos en humanos se conocen desde la antigüedad, y por ello, los arsenicales fueron utilizados en la edad media como agentes homicidas y suicidas.
El arsénico es un sólido quebradizo, cristalino, de color gris acero con propiedades metaloides, que sublima fácilmente, formando vapores amarillos muy tóxicos de color oleáceo. Pertenece al subgrupo V_B la tabla periódica, lo que le confiere una configuración electrónica ns2np3, por lo que forma compuestos estables con números de oxidación -3, 0,+3,+5.
Los compuestos inorgánicos de arsénico son muy tóxicos cuando se ingieren en grandes cantidades, ocurriendo la intoxicación crónica por este metal en el hombre, con acumulación del mismo en los tejidos, como consecuencia de la exposición profesional al mencionado elemento y de una contaminación industrial excesiva de los alimentos y las bebidas.
Según expertos de la agencia internacional del cáncer el arsénico y sus compuestos poseen propiedades cancerígenas para el hombre, y de acuerdo a la vía de entrada al organismo se ha reportado cáncer en piel, pulmón y las vías respiratorias.
La mayor parte del arsénico que existe en el agua y en el medio proviene de la actividad humana. Los productos generados por el hombre incluyen el arsénico metálico, el pentóxido y el trióxido de arsénico, los arseniatos de calcio y plomo; los arsenicales orgánicos, etc. Estas sustancias pasan al medio ambiente durante su empleo como: insecticidas o herbicidas, aleaciones de plomo y cobre, fabricación de semiconductores, fundiciones de minerales emisiones debidas a los hornos de las fabricas que usan carbón ;los de la producción de vidrio u otros procesos de combustión, industria farmacéutica y como preservantes de la madera.
El arseniato inhibe la síntesis del adenosintrifosfato (ATF). En el agua se presentan como As(V) y As(III), también enlazado con el carbono. Se presenta en algunos ríos y embalses a concentraciones entre 0,15-0,45mg/L.
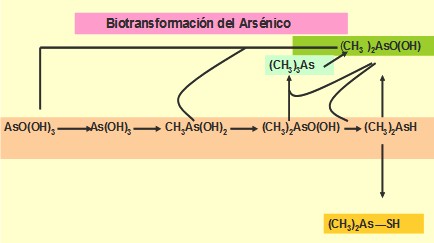
Fig. 1 Biotransformación del Arsénico
Mercurio
Es un elemento metálico que junto al cadmio y al zinc, se ubica en el grupo II-B de la tabla periódica, puede existir en una gran variedad de estados físicos y químicos teniendo las distintas formas de este elemento propiedades toxicas intrínsecas y diferentes aplicaciones en la industria, la agricultura y la medicina.
Desde el punto de vista toxicológico los compuestos organometálicos mas importantes son los alquilmercurio de cadena corta, en los cuales el mercurio esta enlazado al átomo de carbono de un metilo, etilo o propilo y el vapor de mercurio elemental.
Los alquilmercurios, y especialmente el metilmercurio son más tóxicos que los compuestos inorgánicos del mercurio debido a la facilidad que tienen para atravesar las membranas celulares.
Todos los compuestos del mercurio son altamente tóxicos para plantas acuáticas. Concentraciones entre 0.002-0,25 mg/L de HgCl2 dan lugar en plantas a la disminución del crecimiento. Investigaciones han mostrado que el límite mínimo de daños del HgSO4 se encuentra entre 0,15-0,20mg/L de HgSO4. Para fenilmercurio y cloruro de metilmercurio es de 0,025-0,050mg/L. La presencia en el agua de agentes quelantes y partículas suspendidas disminuyen la toxicidad de los compuestos mercuriales.
Los compuestos orgánicos del mercurio son más tóxicos para los peces que los inorgánicos. Por ejemplo para algunos peces la dosis letal media LC50 para 24 horas es de alrededor de 0,084mg/L (0,084-0,125mg/L) y para la misma variedad 0,90 mg/L. También para los peces la toxicidad aguda está relacionada muy estrechamente con la temperatura.
Humanos
Los compuestos organomercuriales pueden dar lugar a la enfermedad de Minamata. La introducción en el organismo del metilmercurio se distribuye por el torrente sanguíneo y se acumula en los riñones, hígado y el cerebro. El período de semieliminación del metilmercurio del organismo como regla es de 70 días, pero puede oscilar entre 35 y 189, lo cual dependerá del tipo de persona. Todas las formas del mercurio se eliminan por las heces fecales, orine y en el pelo. Este último puede servir de indicador del envenenamiento por mercurio.