Toxicos ambientales y salud. Intervencion educativa .4
Los compuestos del mercurio pueden dar lugar a: disminución de la velocidad de replicación del ADN, disminución de la multiplicación de los leucocitos, oponerse a la mitosis en célula. También tiene la propiedad de atravesar la placenta produciendo efectos teratogénicos y embriotóxicos.
La principal fuente de contaminación ambiental con mercurio es la desgasificación natural de la corteza terrestre, la cual aumenta anualmente.
Las industrias que utilizan el mercurio y sus compuestos (productoras de compuestos alcalinos del cloro, equipos eléctricos y pinturas), son la principal fuente antropogénica de mercurio, contaminando la atmosfera, las aguas y los suelos.
Plomo
Pertenece al sub-grupo IV-B de la Tabla Periódica. Así como otros metales, el plomo en su forma natural tiene poca importancia como fuente de contaminación del ambiente. Lo más frecuente es que la contaminación del medio con plomo sea producido por actividades humanas.
El plomo es menos tóxico que otros metales para las plantas acuáticas; como son Hg y Cu. Su acción aguda y crónica se observa entre 0,1-5 mg/l. Aunque se han observado infinidad de casos de efectos tóxicos a nivel de laboratorio. En condiciones naturales estas investigaciones han sido pocas veces realizadas, algunas plantas acuáticas se manifiestan tolerantes, entre ellas la Chlorella y Chlamydomonas a concentraciones entre 5 y 50 mg/l.
El dietil plomo es mas tóxico que el Pb2+ para las plantas acuáticas.
Las industrias que presentan mayor riesgo a la presencia del plomo son:
Alfarería, antidetonantes para gasolina, baterías, cobertura de cables, construcción, imprenta, municiones, pigmentos para pinturas, productos de acero, elementos para protección contra radiaciones y tuberías de plomo. El plomo es menos tóxico para los invertebrados que el Cu, Cd, Zn, Hg pero más tóxico que el Ni, Co, Mn. Toxicidad aguda se observa ya entre 0,1-10 mg/l. Pero, una alta mortalidad, sin embargo, puede observarse a concentraciones tan amplia como 0,002-670 mg/l. Inclusive para invertebrados de agua dulce y de agua de mar. Con el aumento del pH la concentración de Pb2+ en el agua disminuye y de esta forma también disminuye la toxicidad del metal. La presencia de agentes quelantes en el agua también disminuye la toxicidad del Pb2+.
Se ha detectado adaptación de algunos invertebrados aunque el carácter de la adaptación aun no está aclarado, es conocido que en el caso de bacterias y plantas acuáticas, se desarrollan cambios genéticos en las subsecuentes generaciones.
Humanos
Los compuestos solubles del Pb2+ resultan ser los de mayor toxicidad. En el organismo de la persona en los procesos de deposición y transporte, es similar al calcio, por lo que condiciona una alta concentración en el esqueleto. La incorporación del plomo en el organismo humano tiene lugar esencialmente por los órganos de la respiración, lo cual es un índice de las altas concentraciones que hay en la atmósfera.
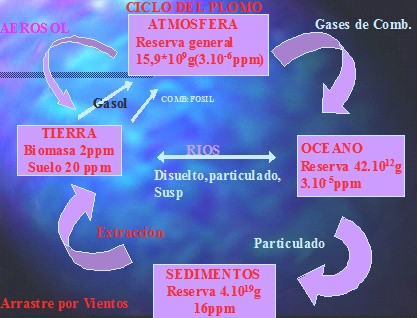
Fig. 2 Ciclo del Plomo.
El plomo se presenta como carcinógeno y teratógeno por lo que resulta un metal de alta peligrosidad para el ser humano.
Individualmente los metales se presentan de la siguiente forma:
La biometilación del plomo se realiza en presencia de concentraciones entre 1-10 mg l-1 de Pb2+
Zn. El Zn en medio acuoso a pH entre 7 y7.5 forma Zn(OH)2. A pH 6-7 Zn2+ y a pH8 se presenta como complejos de cloruro y OH-, asi Zn Cl+, ZnOH+.
Cobre. El cobre forma complejos con el Cl-, OH-,NH3 y se presenta como Cu2+ y CuOH+ a pH bajos y como Cu(OH)2 a pH básicos.
Cadmio. Se hidroliza a pH9 formando CdOH+ hasta pH8 el Cd se presenta como Cd2+.
El cloruro en medio acuoso enlaza al cadmio formando distintos complejos a pH 8.5, así:
Afinidad de los metales pesados por grupos funcionales y grupos donadores de electrones.
En la mayoría de los organismos vivientes e inclusive en disolución acuosa se presentan grupos funcionales a los que los metales se enlazan de distintas formas.
Este tipo de grupos pueden ser encontrados en los siguientes compuestos, localizados en los organismos vivientes.
Grupos -OH: se presentan en los azúcares que forman parte de los sistemas celulares, fluidos biológicos y otros.
Grupos -COOH: se presentan en aminoácidos y proteínas, ácidos grasos, hidroxiácidos etc.
Grupos =S -SH: se encuentran en diversos aminoácidos y proteínas como la cisteína, cistina, metionina, homocisteína.
Grupos =N, =NH, se encuentran en aminoácidos cíclicos y proteínas que contiene estos aminoácidos como: Fenilalanina, tiroxina, triptófano, indol, imidazol, histidina.
Aun lo más alarmante es que los ácidos nucleicos y en específico el DNA portador de los caracteres hereditarios en la célula presenta en sus estructuras sustancias como la desoxirribosa, adenina, guanina, citosina y timina las que tienen grupos funcionales y donadores de electrones como: OH, NH2,N, NH, donde pueden ser atrapados metales pesados formadores de complejos los que les imprimirán a la célula un elemento extraño que pueda alterar su funcionamiento normal.
Puede suponerse que estas estructuras pueden condicionar interacciones con los organismos vivientes de distintas formas ocasionando daños a la flora y fauna e incorporándose a la cadena alimentaria. La tendencia a asociarse (de los metales pesados) a determinados grupos y especies químicas es lo que motiva su afinidad por determinados centros en el organismo, alojándose en la sangre, interrumpiendo la actividad fermentativa de procesos biológicos, incorporándose a tioproteínas y otras sustancias dañando con su acción funciones celulares vitales y alterando inclusive el código genético de estas, cuestión que se manifestará en las futuras generaciones de organismos vivientes.
Es conocido que dentro de los metales pesados existen algunos que desempeñan roles vitales en los organismos vivientes, cuando están a niveles de trazas(conocidos como microelemento) cuando su concentración en el organismo supera la necesaria o no la alcanza, se presentan graves trastornos. Existen otros que presentes en el organismo solo producen daños irreparables.
Rol fisiológico de algunos micro elementos:(actúan sobre las funciones fermentativas)
Cr en la fosfoglitamasa
Co en el hígado y componente de la Vit-12(B-12)
Cu activador de algunos fermentos
Mn activador en el proceso de formación del ácido láctico
Mo en fermentos metaloflavínicos.
Zn activador de más de 10 fermentos en los mamíferos.
Cabe señalar que existen otros metales capaces de sustituir en sus funciones a los ya enumerados con la consecuente intoxicación y muerte del organismo, entre ellos el Cd, Ni, Ag.