|
Nutrigenomica experiencial. Evaluacion perfil absortivo de lipidos y sacarosa obesos dieta VLCD .3
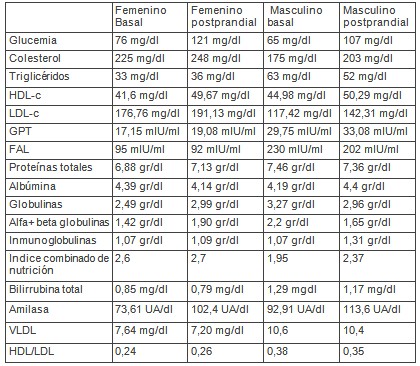
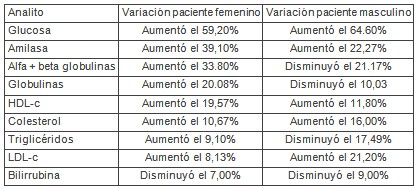
Por lo que son discordantes, entre ambos pacientes, las variaciones de triglicéridos, de alfa+betaglobulinas, y de globulinas totales. Pero como los triglicéridos están relacionados con las betaglobulinas que los transportan, y éstas con las globulinas totales, se podría asumir que el dato discordante es el valor de triglicéridos.
La absorción de hidratos de carbono parece darse eficazmente bajo las condiciones del ensayo con un cifra que supera por mucho los 10 mg/dl esperados en la normoabsorción, siendo de 45 mg/dl para el paciente femenino y de 42 mg/dl para el masculino. Por lo que las dietas VLCD de corta duración, con soporte de sacarosa, no parecen inhibir o disminuir la actividad de las disacaridasas de la mucosa intestinal, con absorción de sacarosa normal o potenciada.
Sin embargo, encontramos una alteración en el perfil de la amilasemia postprandial. En las curvas de tolerancia oral a la glucosa, con la ingesta de una copa de glucosa pura al 20%, hemos observado que los aumentos de glucemia postprandial a los treinta o sesenta minutos de la ingesta, ocurren con una disminución de la amilasemia, producida, probablemente por la hiperglucemia o la hiperinsulinemia.
También hemos observado en gestantes no diabéticas ni prediabéticas sometidas a la toma de un desayuno de prueba conteniendo sacarosa, lactosa y otros hidratos de carbono, con glucemia basal en los límites normales inferiores y glucemia postprandial normal a los 120 minutos (por ejemplo 74/109), una disminución de la amilasemia postprandial (por ejemplo 71,31/50,39). También hemos encontrado en una gestante de 27 semanas, con hemoglobina de 10.6 gr/dl, deficiencia de ácido fólico, incremento no esperado de peso y discreta hiperglucemia a las 2 horas post copa de glucosa pura (130 mg/dl), una amilasa en ayunas de 109,8 UA/dl (valores de referencia hasta 120 UA/dl) y postprandial de 92,05 UA/dl. Mientras que en nuestros pacientes sometidos a una dieta VLCD de corta duración ocurre un incremento de amilasemia postprandial, tras la sobrecarga.
Sería muy interesante evaluar la curva de variación de la amilasemia durante la realización de curvas de tolerancia oral a la glucosa o a distintos carbohidratos o almidones, en pacientes normales, insulinorresistentes y obesos, para sacar más conclusiones.
Nótese, al menos, que el incremento de la amilasemia postprandial no es inducida por los hidratos de carbono de la dieta, puesto que es mayor en el paciente femenino (39.10%), con un aporte casi despreciable de carbohidratos, del orden de 1/3 del ingerido por el paciente masculino, y proporcionado fundamentalmente por la edulcoración de la gelatina (6,8 gr); que en el paciente masculino (22.27%). En el paciente con dieta normo o hipercalórica, un incremento de la glucemia produce una elevación de la insulina que inhibiría la secreción exocrina de amilasa, como una manera de disminuir la glucosa a producir desde los carbohidratos complejos; esta disminución de producción de amilasa se vería reflejada en una disminución de sus niveles sanguíneos.
En las dietas muy hipocalóricas existiría no solo una falta de inhibición de tal secreción exocrina sino probablemente una sobre estimulación de la misma como una necesidad de compensación de la situación carencial.
El modelo secretor e inhibidor se asemejaría al descrito por otros autores (9) al trabajar con ratas macho esplacnicectomizadas y solarectomizadas, evaluando la amilasemia y lipasemia basales y postprandiales, al mes de operadas. Como la solarectomía aumenta el tamaño y número de los islotes de Langerhans, se esperaba un incremento de insulina con una curva plana de glucosa, que no aconteció, y una alteración de la síntesis y excreción de los pancreones peri insulina, debido a una acción paracrina de la misma. Estos autores encuentran un incremento del 125% de la amilasemia basal y de 147% post prandial, en la esplacnicectomización; y una marcada disminución de la lipasa basal del 100% en ambas operaciones, y del orden del 96%, de promedio de ambas, en la postprandial.
Es decir que se incrementó en un 22.00% la amilasemia postprandial respecto a la basal, en la experiencia de aquellos autores; como en el caso del paciente masculino estudiado por nosotros (22.27%)
Es conocido que en los pacientes con diabetes MODY 7 existe una mutación del gen CEL con función sobre las enzimas del páncreas exocrino. (12)
Sin embargo, en estudios efectuados en pacientes con distintos tipos de diabetes, también se encontró que la función exocrina medida por la concentración de elastasa fecal fue normal en 47 pacientes (67%), moderadamente disminuida (elastasa 100-200 µg/g) en 10 pacientes (14%), y severamente disminuida (elastasa <100 µg/g) en 13 pacientes (19%). (13).
El 50% (5/10) de los pacientes con insuficiencia exocrina moderada y 61,5% (8/13) de los severos, presentaba sobrepeso u obesidad según el índice de masa corporal (IMC). (13)
Aproximadamente un tercio de los pacientes diabéticos presenta un grado moderado o severo de insuficiencia exocrina. La magnitud del problema, sin embargo, puede ser aún mayor. Es probable que un porcentaje adicional de estos pacientes tenga un grado leve de disminución de la función exocrina, no detectable mediante la determinación de elastasa fecal y que el uso de un test directo revelara una proporción mayor de enfermos con insuficiencia exocrina. Además, en nuestra serie sólo 4% de los pacientes era diabético tipo 1, que es el grupo con mayor riesgo de insuficiencia exocrina. (13)
Todo lo cual sugeriría que la hiperinsulinemia postprandial en pacientes normales, en diabéticos, insulinorresistentes, y obesos, con dietas normo o hipercalóricas, podrían, por mecanismos paracrinos, disminuir en distinto grado la secreción exocrina del páncreas; lo que no ocurriría en pacientes obesos resistentes a la insulina tras una dieta VLCD de corta duración, cuyo perfil secretorio exocrino sería semejante a aquella situación descripta con recuperación del número de islotes del páncreas endócrino funcionante.
Según vemos no solo los genes pueden modular el aprovechamiento de los nutrientes codificando proteínas que regulan el metabolismo, por ejemplo enzimas, proteínas transportadoras, proteínas de membrana, etc. Sino que a su vez los nutrientes pueden modular la expresión génica directamente o indirectamente través de intermediarios metabólicos, segundos mensajeros u hormonas cuya expresión, síntesis o secreción viene regulada por ellos (12), como acontece con el nutriente glucosa y la hormona insulina.
Un buen ejemplo de la regulación génica por parte de nutrientes lo provee el operón lac de Escherichia coli, en donde los intermediarios metabólicos liberan el locus de control del represor permitiendo la transcripción de genes metabólicos y el aprovechamiento de la lactosa del medio.
Esta regulación génica inducida por nutrientes puede hacerse a nivel citoplasmático a través del control de cascadas de transducción de señales que culminan en procesos de modulación génica, o a nivel nuclear al actuar como ligandos de receptores nucleares que ejercen su acción al unirse a secuencias situadas en las regiones promotoras de los genes. (12)
|