Durante la fecundación el espermatozoide debe atravesar:
a) la corona radiante, b) la zona pelúcida y c) la membrana celular del ovocito [12, 13, 14, 15, 16].
En cuanto el espermatocito ha penetrado en el ovocito, este responde: a) reacciones corticales y de zona, (liberación de gránulos corticales del ovocito con lisoenzimas, modificación de la estructura y composición de la zona pelúcida que impide unión y penetración de otros espermatozoides), b) este completa su segunda división meiótica y forma el segundo cuerpo polar (pronúcleo femenino), y c) la cabeza del espermatozoide se separa de la cola, se hincha y se forma el pronúcleo masculino. Una vez que ambos pronúcleos han duplicado su DNA, se entremezclan los cromosomas paternos y maternos, se dividen longitudinalmente y experimentan una división mitótica que da origen a la etapa bicelular.
Los resultados de la fecundación son: a) restablecimiento del número diploide de cromosomas; b) determinación del sexo cromosómico, y c) iniciación de la segmentación.
La segmentación es una serie de divisiones mitóticas que provoca un aumento de las células, blastómeras, que se tornan más pequeñas con cada división. Después de tres divisiones las blastómeras entran en un proceso de compactación y forman un conjunto apretado de células, con una capa interna y otra externa. Las blastómeras compactadas se dividen para formar la mórula de 16 células.
Cuando la mórula penetra en la cavidad uterina, 3 o 4 días después de la fecundación, comienza a formarse una cavidad, el blastocisto. La masa celular interna, formada en el momento de la compactación, se transformará en el embrión propiamente dicho y se situará en el polo del blastocisto. La masa celular externa (MCE), que rodea a las células internas (MCI) y a la cavidad del blastocisto, formara el trofoblasto. Para entonces desaparece la zona pelúcida permitiendo la implantación. Durante la implantación las células trofoblásticas sobre el polo del embrión comienzan a introducirse entre las células epiteliales de la mucosa uterina, la penetración y erosión del endometrio es producida por liberación de enzimas proteolíticas por los trofoblastos.
El blastocisto humano en condiciones normales se implanta las paredes posterior o anterior del cuerpo uterino. Al comienzo de la segunda semana (8º día), el blastocisto está parcialmente incluido en el estroma endometrial. El trofoblasto se diferencia en: a) una capa interna de proliferación activa, el citotrofoblasto y b) una capa externa sincitiotrofoblasto, que ocasiona erosión de los tejidos maternos. Mientras tanto la masa celular interna o embrioblasto se diferencia en a) epiblasto y b) en el hipoblasto, los cuales unidos forman el disco germinativo bilaminar. Hacia el noveno día del desarrollo el blastocisto se ha introducido más profundamente en el endometrio y un coágulo de fibrina cierra la solución de continuidad del epitelio superficial. No es hasta el undécimo o duodécimo días de desarrollo que el blastocisto queda incluido por completo en el estroma endometrial, y el epitelio endometrial casi cubre por completo el defecto de la pared del útero [12, 13, 14, 15, 16, 17].
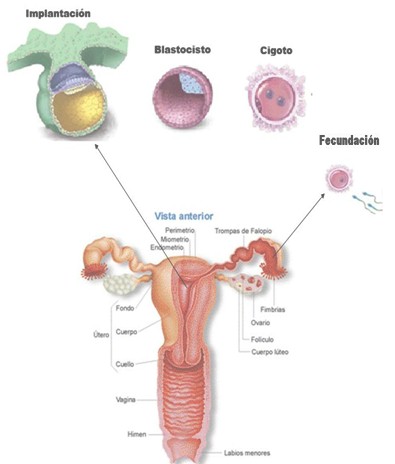
Figura-2: Muestra la anatomía de los órganos genitales femeninos, las fechas indican sitios donde deben ocurrir normalmente la fecundación y la implantación o nidación.
Farmacología
Estrógenos
Los esteroides constituyen una clase de lípidos derivados del hidrocarburo tetracíclico saturado ciclopentanoperhidrofenantreno, que presenta cuatro anillos (A, B, C, D), siendo el D de cinco carbonos, el colesterol difiere del sistema de anillos básico en que posee una cadena alifática en C-17, un doble enlace en el anillo B, grupos metilos axilares en C-10 y C-13, y un grupo hidroxilo en el anillo A. El grupo funcional alcohol y la cadena de carbono de C-17 hacen que este sea un esterol, término genérico utilizado para identificar a los alcoholes esteroideos. El colesterol es el origen biosintético de todas las hormonas esteroideas, una de sus características generales es que no se almacenan para su liberación tras la síntesis, por lo que sus concentraciones circulantes son controladas fundamentalmente mediante su tasa de síntesis, la cual en última instancia se controla por señales cerebrales.
Se consideran cinco clases principales de hormonas esteroideas:
1) los progestágenos (progesterona),
2) los estrógenos (estrona y estradiol),
3) los glucocorticoides (cortisol y corticosterona),
4) mineralocorticoides (aldosterona), 5) andrógenos (androstenediona y testosterona), [18].
La actividad estrogénica es compartida por muchos compuestos esteroides y no esteroides, el estrógeno natural más potente en los seres humanos es el 17-β-estradiol, seguido por la estrona y el estriol. Estas moléculas están compuestas por 18 carbonos con un anillo fenólico A (anillo aromático con un grupo hidroxilo en el carbono 3), siendo esta la principal característica estructural, de la cual depende la unión selectiva de alta afinidad a receptores de estrógenos, y un grupo β-hidroxilo o cetona en la posición 17 del anillo D. la mayoría de las sustituciones alquil en el anillo fenólico A alteran la unión a sus receptores, mientras la sustituciones etinil en la posición C-17 incrementan mucho la potencia por vía oral al inhibir el metabolismo hepático del primer paso [19].
Al igual que otras hormonas esteroideas los estrógenos actúan principalmente mediante la regulación de la expresión genética. Las propiedades lipófilas (naturaleza hidrófoba) de estas hormonas les permite difundir de modo pasivo a través de las membranas celulares para unirse a proteínas receptoras específicas (denominadas receptores nucleares debido a su sitio de acción), ubicadas en el citosol, que presenta gran homología con receptores para otras hormonas esteroides, vitamina D, retinoides y hormona tiroidea. Los receptores nucleares, (Figura 3), presentan una masa molecular aproximada de 66.000 Da, se encuentran a concentraciones de tan solo unas 104moléculas por células. Se han identificado dos receptores diferentes que son, ERα, ERβ, productos de genes separados. Ambos receptores humanos comparten la estructura del dominio común para los miembros de la familia y presentan una estructura 44% idéntica en su secuencia global de aminoácidos. Al parecer los receptores muestran diferentes funciones biológicas y pueden reaccionar de manera distinta a diversos compuestos estrogénicos [18, 19, 20, 21].
Cada proteína receptora de esta familia contiene seis dominios funcionales (Figura 4), un dominio C, central conservado de unos 80 residuos, que participa en la unión al ADN que incluye cuatro cisteínas dispuestas en dos dedos de zinc; el dominio A/B en el lado N-terminal de este se encuentra una región especial para la activación de la transcripción [el segmento de función de activación-1 (AF1)], independiente de ligando; el dominio D, contiene la señal de localización nuclear y reconocido como “región de la bisagra”; Hacia el C-terminal se encuentran los dominios encargados de la unión de la hormona, la dimerización de la proteína y la activación de la transcripción [dominio E/F de múltiples funciones mediadas por dominio (AF-2)], este dominio muestra comúnmente un pliegue helicoidal de 12 hélices (Figura 5).
La unión en el citosol a las proteínas receptoras específicas, que forman dímeros bajo la influencia del estrógeno, el cambio de conformación origina mayor afinidad y magnitud de la unión del receptor al DNA, y va seguido de un movimiento del complejo hormona-receptor hacia el núcleo, donde interacciona con lugares específicos del ADN denominados elementos que responden a las hormonas (ERE). La unión del complejo al ADN influye en la velocidad de trascripción de los genes próximos regulados por hormonas, mediante mecanismos intensamente estudiados en la actualidad. El complejo receptor-ADN recluta varias proteínas coactivadoras hasta el promotor, como la CBP (proteína de unión con elementos de respuesta de AMP-cíclico) y SRC-1 (coactivador 1 del receptor de esteroides). Estos coactivadores poseen actividad acetilasa de histonas. La acetilación de las histonas altera la estructura cromatínica en la región promotora de los genes diana y permite ensamblarse e iniciar transcripción a las proteínas del aparato transcripcional general [18, 19, 20, 21].
Todos los receptores conocidos de esta familia contienen zinc unido, esencial para la unión al ADN, y las secuencias e unión al ADN presentan una distribución de cisteína completamente conservada. Observaciones que sugieren la formación de complejos de los átomos de zinc con los azufres de la cisteína con un patrón similar al del “dedo de zinc” que es un motivo estructural que se repite en otras proteínas reguladoras de la transcripción en las eucariotas.