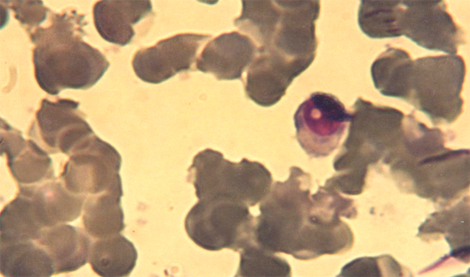
Paraforma de neutrófilo inducida por la radiación, con ventanas de Owren-Oswald
Los LPMNn polilobulares o polilobocitos, que son más viejos, alteran menos la morfología de sus núcleos cuando se exponen a la radiación, observándose la persistencia de, al menos, un filamento interlobulillar. Esta observación experimental resulta de sumo interés para la radiobiología, y será retomada luego, cuando tratemos la relación entre la radiosensibilidad y la heterocromatinización. No se observa en estas entidades más viejas tumefacción nuclear ni citoplasmática, limitándose los cambios nucleares a una ligera agrumación de cromatina, como ocurre en las lesiones leves, hacia los bordes de los lóbulos.
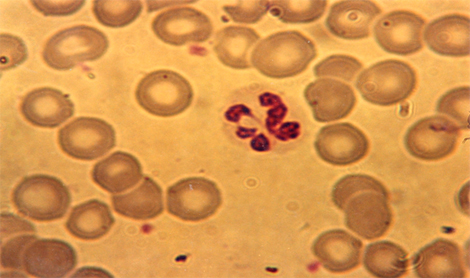
Se observa la presencia de un polilobocito, hematíes y algunas plaquetas, correspondiente a una muestra de sangre normal irradiada. Nótese la agrumación de la cromatina hacia los bordes de los lóbulos.
La descripción anterior nos sugiere que las primeras alteraciones inducidas por la radioactividad (en los leucocitos polimorfonucleares, ricos en peroxidasa y por lo tanto con efecto peróxido reducido o ausente), serían de índole nuclear, con redistribución de la cromatina y sin vacuolizaciones. La ausencia de vacuolización nos estaría indicando la ausencia o minimización del efecto peróxido por salvaguarda de las peroxidasas neutrófilas. Los radicales aniónicos (O2-) pueden transformarse en oxígeno simple por un mecanismo no enzimático y atacar, al igual que otros radicales libres, los lípidos poliinsaturados de las membranas celulares dando lugar a la formación de hidroperóxidos lipídicos. Estos son inestables en presencia de vestigios de iones metálicos de transición y se descomponen en radicales libres de lípidos. Las vacuolas celulares son buenos marcadores de daños de membrana producidos, sobre todo, por los radicales libres, provengan o no del oxígeno, y cuyo efecto se propaga en la peroxidación de lípidos.
Posterior a la redistribución cromatínica se produciría una desaparición de los filamentos interlobulillares, muy densos en cromatina para sus pequeñas dimensiones, y por lo tanto más radiosensibles que el resto de la estructura nuclear; y una tendencia a la Pelgerización Stodmeisteriana. Es útil recordar que la anomalía de Pelger-Huet o falta de segmentación de los neutrófilos con condensación grosera de su cromatina es una entidad de etiología genética que se transmite con carácter autosómico dominante. La cromatina de los núcleos de Pelger-Huet se caracteriza por su concentración grosera formando masas que han determinado su designación de núcleo en escarapela. Tales leucocitos, no obstante, conservan intacto su funcionalismo, estando disminuida la proporción de palillos de tambor en los casos femeninos debido a la compactación de la cromatina. (6)
Al parecer tal compactación no produciría inhibición de los genes bajo cuyo control se sintetizan las enzimas de diferenciación y especialización.
El corpúsculo de Barr observable en el núcleo de las células femeninas en interfase, al igual que los palillos de tambor o drumstick observables en el núcleo de los LPMNn, son el mejor ejemplo de heterocromatina y corresponden a un cromosoma X inactivado. Este cromosoma, debido a la mayor espirilización, replica más tardíamente y permanece condensado más tiempo que el otro cromosoma X ; lo cual explica su aparición de modo visible durante la interfase. En los núcleos de Pelger-Huet, como está condensada toda la cromatina, enmascara al cromosoma X condensado que se torna en no visible en la interfase.
Los cromosomas sexuales tienden a estar entre los últimos cromosomas que alcanzan los polos del huso mitótico durante el movimiento anafásico. Ocasionalmente, uno puede rezagarse tanto en relación con los otros que la lámina celular se cierre entre ambos polos antes de que el cromosoma sexual pueda llegar a su destino. El resultado es que un cromosoma puede ser incluido en la otra célula o ser excluido de ambas, dando lugar a una aneuploidía, o a cromosomas aislados, respectivamente, (6) y positivando el ensayo del micronúcleo tan empleado para evaluar la inestabilidad genética por exposición a genotóxicos.
Otra entidad de etiología genética en la que es frecuentes la disminución del número de lóbulos de los LPMN es el síndrome del maullido de gato, que es el más característico de las cromosomopatías del grupo B, y en la cual se encuentra una delección parcial de los brazos cortos del par cromosómico número 5, que es el más pequeño y el que replica más precozmente. También se han descripto cromosomas 5 en anillo en el síndrome en cuestión. (6)
En el síndrome de Down ocurre un aumento de la fosfohexoquinasa que sugiere que el locus del gen responsable de esta enzima guarda relación con el cromosoma 21, una disminución en la vía metabólica de la serotonina y una inhibición de la maduración de los polimorfonucleares, con disminución del número de lóbulos y de la frecuencia de drumstiks en las hembras. (6)
Estudios experimentales en animales y en cultivos in vitro de material humano, efectuado por otros autores, demuestran que las radiaciones (ionizantes, no ionizantes, gamma, neutrones), son capaces de lesionar la célula y producir alteraciones cromosómicas. Las observaciones clínicas de pacientes irradiados accidentalmente, terapéuticamente o con fines diagnósticos, mostraron que las lesiones cromosómicas más frecuentes ocasionadas consistían en cromosomas dicéntricos, anulares, y algunas delecciones que dan lugar a cromosomas similares al Ph. (10)
Tales autores consideran que es imposible determinar con exactitud la intensidad o la dosis de radiación para producir una lesión cromosómica en la especie humana, ya que las lesiones constatadas son una mínima parte de las producidas, pues traducen sólo las de las células supervivientes a la lesión. (10) De todas formas, la radiactividad abre primero en la membrana citoplasmática y estructuras vecinas, cilindros de ionización, y posteriormente en la nuclear. Pero como los cromosomas estarían todavía intactos se pondrían en juego mecanismos reparacionales de la lesión. Tales mecanismos dejarían de funcionar con la lesión de los genes o de los cromosomas responsables de tal proceso de reparación. Por eso, tal vez, en la acción biológica de la radiactividad por efecto del choque directo independiente del efecto peróxido, los cambios atípicos tienen mayor lugar en el núcleo, y se ven poco las formas de vacuolización por degeneración hidrópica. Es interesante recordar que para que ocurra la reparación de membranas no solo deberá estar intacto el mecanismo citoplasmático y/o nuclear que gatilla la orden al núcleo de la codificación de la enzima reparadora, sino todo el mecanismo de la síntesis proteica, y que éste, al parecer, sería viable aun cultivando las células en medio mínimo y a 30ºC. Esta viabilidad la hemos comprobado no solo en experiencias de fagocitosis lenta, que es un excelente certificado de integridad de los sistemas metabólicos y por ende de viabilidad de la célula, sino siguiendo la evolución celular durante una semana, en sangre en medio autólogo mínimo, pero adicionado de cobre, peróxido de hidrogeno, oxidasa de la glucosa y peroxidasa.
En otra experiencia de inducción con dipirona, inhibidora de la síntesis de prostaglandinas, hemos observado la viabilidad celular a las 82 hs por incremento de la proliferación celular consecuente al agregado exógeno de glucosa pura.