Modelo de estudio del choque directo radioactivo independiente del efecto peroxido .8
Las vacuolizaciones producidas en algunos LPMNn y eosinófilos por el presente modelo, son mucho menores cualitativa y cuantitativamente que en las experiencias de morfogénesis inducida con sustancias oxidantes y R.L., y más frecuentes las nucleares que las citoplasmáticas. Esto evidenciaría que la radioactividad produciría más perturbaciones en la membrana del núcleo que en la del citoplasma, lo cual es obvio si consideramos que es una zona más electrodensa.
A las 24 horas de exposición al radionucleido va creciendo el porcentaje de células blastoideas, con una neta orientación hacia el predominio de estadios III y IV de pseudoinmaduración.
Con 56 horas de exposición al radioiodo se comienza a observar heterocromatinización nuclear, lo que supone una inhibición de genes que dejarían de estar expuestos al sistema de copias y duplicación nuclear.
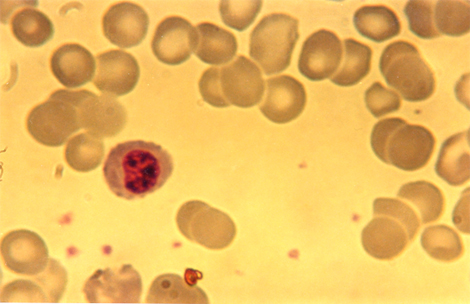
Nótese los acúmulos de heterocromatina en el núcleo unilobular del neutrófilo irradiado.
Posteriormente se acentúan las masas de cromatina y comienzan a producirse delecciones.
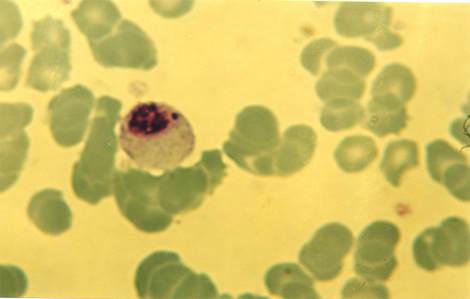
Nótese un cromosoma deleccionado con aspecto de micronúcleo.
Los cambios producidos en leucocitos a las 56 horas de exposición radioactiva nos demostraría una vez más la viabilidad de los mismos durante ese período, en sangre entera cultivada en medio antólogo mínimo. Tal viabilidad la hemos demostrado en una experiencia de fagocitosis fúngica lenta en medio privado de calcio; y es observable también en una experiencia de inducción con radicales libres del peróxido de hidrógeno y del cobre, a las 92 horas de la venipuntura. Según algunos autores, la misma sería de hasta 15 días o más en leucocitos cultivados en coágulo plasmático autólogo blando; y al ser puesta de manifiesto por nosotros en un fenómeno biológico tan impresionante como la fagocitosis, nos demuestra la integridad funcional de las vías metabólicas celulares en tales condiciones de cultivo.
Recurriendo a la enzimología observamos que las reacciones cinéticas se producen, aunque en menor cuantía, a temperatura acorde con la del ambiente. Por otro lado, las enzimas son proteínas que actúan como catalizadores de reacciones químicas y, como tales, no alteran la dirección de la reacción (salvo en el alosteronismo) sino la velocidad de la misma; por disminución de la energía de activación necesaria. A medida que se eleva la temperatura aumenta la velocidad de la reacción llegando a un valor óptimo o máximo luego del cual desciende rápidamente a cero.
El valor Q10 o aumento de la actividad por cada 10ºC de elevación de la temperatura, varía entre 1.6 a 2.3, con una media de 2.0; si consideramos que la temperatura fisiológica va desde los 31ºC a los 45ºC, a la temperatura ambiente media las reacciones biológicas se desarrollarían en el doble de tiempo, que en condiciones fisiológicas algo extremas, y en el cuádruple de tiempo que en condiciones fisiológicas óptimas. A la temperatura ambiente, sin embargo, determinados procesos se retardan y otros se aceleran al doble o más, de la velocidad con que transcurren en condiciones fisiológicas. (1)
El efecto de la temperatura es el resultado de dos fenómenos, el aumento de la velocidad de la reacción química por aumento de la temperatura y el incremento de la velocidad de desnaturalización de la enzima y pérdida de la actividad catalítica. La T óptima para la mayoría de las enzimas se encuentra entre 37-42ºC, mientras que se tornan inactivas a T superiores a 50-55ºC. (1)
También resulta una prueba de viabilidad las escasas células observadas, a las 56 horas, con evaginaciones citoplasmáticas y cariólisis, porque eso nos demuestra la existencia de un mecanismo reparacional intenso de las membranas dañadas por el bombardeo radiactivo. En realidad, las evaginaciones y burbujas citoplasmáticas no se deben interpretar siempre como patentes de lesión de membrana; sino que pueden corresponder, según el resto del estado celular, a signos de intenso movimiento citoplasmático y de intensa actividad. (9)
Acción del 125 Iodo sobre leucocitos de sangre periférica (LSP) de leucemia mieloide crónica (LMC).
Con el propósito de observar la acción del radioiodo sobre elementos inmaduros de la serie granulocítica, se efectuó una nueva experiencia con 100 µl de sangre entera en medio autólogo mínimo, correspondiente a paciente de sexo masculino, de 22 años de edad, con padecimiento de leucemia mieloide crónica (LMC) y antecedentes de ACV por TE.
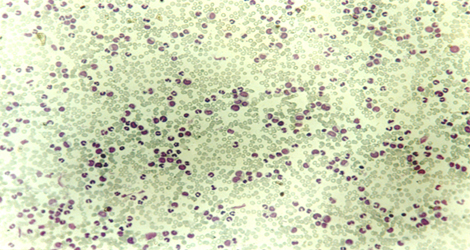
Microfotografía de muestra de sangre de leucemia mieloide crónica a pequeño aumento.